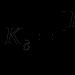Alkaanide alkeenide alküünide kasutamine. Alkeenide füüsikalised omadused, kasutamine, saamismeetodid. Alküünide nimetused ja nende omadused
MÄÄRATLUS
Alkeenid- küllastumata süsivesinikud, mille molekulid sisaldavad ühte kaksiksidet; alkeenidel on järelliide -een või -üleen.
Alkeenide homoloogse seeria üldvalem (tabel 2) on C n H 2n
Tabel 2. Alkeenide homoloogsed seeriad.
Alkeenidest moodustunud süsivesinikradikaalid: -CH \u003d CH2 - vinüül ja -CH 2 -CH \u003d CH 2 - allüül.
Alkeenidele, alustades buteenist, on iseloomulik süsinikskeleti isomeeria:
CH2-C(CH3)-CH3(2-metüülpropeen-1)
ja kaksiksideme positsioonid:
CH2 = CH-CH2-CH3 (buteen-1)
CH 3 -C \u003d CH-CH 3 (buteen-2)
Alkeene, alates buteen-2-st, iseloomustab geomeetriline (cis-trans) isomeeria (joonis 1).
Riis. 1. Buteen-2 geomeetrilised isomeerid.
Alkeene, alates propeenist, iseloomustab klassidevaheline isomeeria tsükloalkaanidega. Niisiis vastab C 4 H 8 koostis alkeenide ja tsükloalkaanide klassi ainetele - buteen-1 (2) ja tsüklobutaan.
Süsinikuaatomid alkeeni molekulides on sp 2 hübridisatsioonis: 3σ sidemed paiknevad samas tasapinnas üksteise suhtes 120° nurga all ning π sideme moodustavad naabersüsinikuaatomite p elektronid. Kaksikside on σ- ja π-sidemete kombinatsioon.
Alkeenide keemilised omadused
Enamik alkeenide keemilisi reaktsioone kulgeb elektrofiilse lisamise mehhanismi kaudu:
- hüdrohalogeenimine - alkeenide interaktsioon vesinikhalogeniididega (HCl, HBr), mis toimub Markovnikovi reegli järgi (kui HX-tüüpi polaarsed molekulid on seotud ebasümmeetriliste alkeenidega, on vesinik seotud kaksiksideme kaudu rohkem hüdrogeenitud süsinikuaatomiga)
CH 3 -CH \u003d CH 2 + HCl \u003d CH 3 -CHCl-CH 3
- hüdratsioon - alkeenide interaktsioon veega mineraalhapete (väävel-, fosforhape) juuresolekul alkoholide moodustumisega Markovnikovi reegli järgi
CH 3 -C (CH 3) \u003d CH 2 + H 2 O \u003d CH 3 -C (CH 3)OH-CH 3
- halogeenimine - alkeenide interaktsioon halogeenidega, näiteks broomiga, mille käigus broomivesi muutub värvituks
CH 2 \u003d CH 2 + Br 2 \u003d BrCH 2 -CH 2 Br
Kui alkeeni ja halogeeni segu kuumutatakse temperatuurini 500 °C, saab alkeeni vesinikuaatomi asendada radikaalse mehhanismiga:
CH 3 -CH \u003d CH 2 + Cl 2 \u003d Cl-CH 2 -CH \u003d CH 2 + HCl
Alkeenide hüdrogeenimine toimub vastavalt radikaalimehhanismile. Reaktsiooni kulgemise tingimuseks on katalüsaatorite (Ni, Pd, Pt) olemasolu, samuti reaktsioonisegu kuumutamine:
CH 2 = CH 2 + H 2 \u003d CH 3 - CH 3
Alkeene on võimalik oksüdeerida, moodustades erinevaid tooteid, mille koostis sõltub oksüdatsioonireaktsiooni tingimustest. Niisiis, oksüdeerimisel kergetes tingimustes (oksüdeerija on kaaliumpermanganaat) katkeb π-side ja moodustuvad kahehüdroksüülsed alkoholid:
3CH 2 \u003d CH 2 + 2KMnO 4 + 4H 2 O \u003d 3CH 2 (OH) -CH 2 (OH) + 2MnO 2 + 2KOH
Alkeenide kõva oksüdeerimise ajal keeva kaaliumpermanganaadi lahusega happelises keskkonnas toimub sideme (σ-side) täielik purunemine ketoonide, karboksüülhapete või süsinikdioksiidi moodustumisega:
Etüleeni oksüdeerimine hapnikuga 200 C juures CuCl 2 ja PdCl 2 juuresolekul viib atseetaldehüüdi moodustumiseni:
CH 2 = CH 2 + 1 / 2O 2 = CH 3 - CH \u003d O
Alkeenid läbivad polümerisatsioonireaktsiooni. Polümerisatsioon – suure molekulmassiga ühendi – polümeeri – moodustumise protsess omavahel kombineerides, kasutades algse madala molekulmassiga aine – monomeeri – molekulide peamisi valentse. Polümerisatsiooni võivad põhjustada kuumus, ülikõrge rõhk, kiirgus, vabad radikaalid või katalüsaatorid. Seega toimub etüleeni polümerisatsioon hapete (katioonmehhanism) või radikaalide (radikaalmehhanism) toimel:
n CH2 \u003d CH2 \u003d - (-CH2-CH2-) n -
Alkeenide füüsikalised omadused
Normaaltingimustes C 2 -C 4 - gaasid, C 5 -C 17 - vedelikud, alustades C 18 - tahked ained. Alkeenid ei lahustu vees, lahustuvad orgaanilistes lahustites.
Alkeenide saamine
Peamised viisid alkeenide saamiseks:
— alkaanide halogeenderivaatide dehüdrohalogeenimine leeliste alkoholilahuste toimel
CH 3 -CH 2 -CHBr-CH 3 + KOH \u003d CH 3 -CH \u003d CH-CH 3 + KBr + H 2 O
— dihalogeenitud alkaanide dehalogeenimine aktiivsete metallide toimel
CH3-CHCl-CHCl-CH3 + Zn = ZnCl2 + CH3-CH = CH-CH3
- alkoholide dehüdratsioon, kui neid kuumutatakse väävelhappega (t > 150 C) või alkoholiauru juhitakse üle katalüsaatori
CH 3 -CH (OH) - CH 3 \u003d CH 3 -CH \u003d CH 2 + H 2 O
- alkaanide dehüdrogeenimine kuumutamisel (50 °C) katalüsaatori (Ni, Pt, Pd) juuresolekul
CH3-CH2-CH3 \u003d CH3-CH \u003d CH2 + H2
Alkeene kasutatakse toorainena polümeersete materjalide (plastid, kummid, kiled) ja muude orgaaniliste ainete tootmisel.
Näited probleemide lahendamisest
NÄIDE 1
| Harjutus | Määrake alkeeni molekulvalem, kui on teada, et sama kogus seda moodustab halogeenidega interakteerudes vastavalt kas 56,5 g dikloroderivaati või 101 g dibromoderivaati. |
| Lahendus | Alkeenide keemilised omadused määratakse nende võime järgi lisada aineid elektrofiilse lisamise mehhanismi abil, samas kui kaksikside muutub üksiksidemeks: CnH 2 n + Cl 2 → CnH 2 nCl 2 CnH 2 n + Br 2 → CnH 2 nBr 2 Reageerinud alkeeni mass on sama, mis tähendab, et reaktsioonis osaleb sama arv moole alkeeni. Avaldame süsivesinike moolide arvu, kui dikloroderivaadi molaarmass on 12n + 2n + 71, dibromoderivaadi molaarmass on (12n + 2n + 160): m (CnH 2 nCl 2) \ (12n + 2n + 71) \u003d m (CnH 2 nBr 2) \ (12n + 2n + 160) 56,5 \ (12n+2n+71) = 101 \ (12n+2n+160) Seetõttu on alkeenil valem C3H6 on propeen. |
| Vastus | Alkeeni valem C3H6 on propeen |
NÄIDE 2
| Harjutus | Tehke rida teisendusi etaan → etaan → etanool → etaan → kloroetaan → butaan |
| Lahendus | Eteeni saamiseks etaanist on vaja kasutada etaani dehüdrogeenimisreaktsiooni, mis kulgeb katalüsaatori (Ni, Pd, Pt) juuresolekul ja kuumutamisel: C2H6 → C2H4 + H2 Etanooli tootmine eteenist viiakse läbi veega voolava hüdratsiooni reaktsioonil mineraalhapete (väävel-, fosforhape) juuresolekul: C 2 H 4 + H 2 O \u003d C 2 H 5 OH Eteeni saamiseks etanoolist kasutatakse dehüdrogeenimisreaktsiooni: C2H5OH → (t, H2SO4) → C2H4 + H2O Kloroetaani tootmine eteenist toimub hüdrohalogeenimisreaktsiooniga: C2H4 + HCl → C2H5Cl Butaani saamiseks kloroetaanist kasutatakse Wurtzi reaktsiooni: 2C 2 H 5 Cl + 2 Na → C 4 H 10 + 2 NaCl |
Nad põlevad.
1. Põlemine õhus
2. Oksüdeerimine permanganaadi vesilahusega (Wagneri reaktsioon)
Neutraalses keskkonnas saadakse pruun mangaanoksiid (IV) ja orgaanilise aine kaksiksidemega on seotud kaks OH-rühma:
Vasakul on kaaliumpermanganaadiga alkeen, paremal alkaan. Orgaaniline kiht (ülemine) ei segune veekihiga (alumine). Paremal ei ole permanganaadi värv muutunud. Riis. üks.

Riis. 1. Wagneri reaktsioon
3. Oksüdeerimine hapendatud permanganaadi lahusega
Happelises keskkonnas muutub lahus värvituks: Mn +7 redutseeritakse Mn +2-ks. Hapendatud kaaliumpermanganaadi lahuse värvimuutus - kvalitatiivne reaktsioon küllastumata ühenditele.
5CH 2 = CH 2 + 12 KMnO 4 + 18H 2 SO 4 = 12 MnSO 4 + 10CO 2 + 6K 2 SO 4 + 28 H 2 O.
Oksüdatsiooniproduktide sõltuvus alkeeni struktuurist:

Radikaalne asendus alkeenides
Propeen ja kloor kõrgel temperatuuril: 400-500 o C (radikaalreaktsioonide jaoks soodsad tingimused) annavad toote mitte lisamise, vaid asendamise.
Tööstuses alkeenid saadakse nafta alkaanide krakkimise või dehüdrogeenimise teel.
Laboratoorsed meetodid lõhustamisreaktsioonide põhjal alkeenide saamine.
1. Dehalogeenimine
Dihaloalkaanide, mille molekulides halogeeniaatomid asuvad naabersüsinikuaatomite juures, reaktsioon magneesiumi või tsingiga viib kaksiksideme moodustumiseni:
CH 2 Cl-CH 2 Cl + Zn → CH 2 \u003d CH 2 + ZnCl 2
2. Dehüdrohalogeenimine
Kui haloalkaanid reageerivad leelise kuuma alkoholilahusega, eraldub vesinikhalogeniidi molekul ja moodustub alkeen:
CH3-CH2-CHCl-CH3 + KOH alkohol. CH 3 -CH \u003d CH-CH 3 + KCl + H 2 O
3. Dehüdratsioon
Alkoholide kuumutamine kontsentreeritud väävel- või fosforhappega viib vee eemaldamiseni ja alkeeni moodustumiseni.
Ebasümmeetriliste haloalkaanide ja alkoholide eliminatsioonireaktsioonid kulgevad sageli vastavalt Zaitsevi reegel: Vesinikuaatom on valdavalt eraldatud C-aatomite omast, mis on seotud väikseima arvu H-aatomitega.
Zaitsevi reeglit, nagu ka Markovnikovi reeglit, saab seletada reaktsioonis tekkivate vaheosakeste stabiilsuse võrdlemisega.
Etüleen, propeen ja buteenid on naftakeemia sünteesi lähtematerjalid, eelkõige plastide tootmisel.
Kui alkeenidele lisatakse kloori, saadakse kloori derivaadid.
CH2 \u003d CH-CH3+Cl 2 → CH 2 Cl- CHCl- CH 3 (1,2-dikloropropaan)
Kuid juba 1884. aastal leidis vene teadlane Lvov M.D. (Joonis 2) viis propeeni kloorimisreaktsiooni läbi raskemates tingimustes, temperatuuril t = 400 0 C. Selle tulemusena ei olnud produkt mitte kloori lisamine, vaid asendus.
CH2 \u003d CH-CH3+Cl 2 CH2 \u003d CH-CH2Cl + HCl

Riis. 2. Vene teadlane M.D. Lviv
Samade ainete koostoime erinevates tingimustes annab erinevaid tulemusi. Seda reaktsiooni kasutatakse laialdaselt glütserooli saamiseks. Mõnikord kasutatakse etüleeni köögiviljapoodides, et kiirendada puuviljade valmimist.
Õppetunni kokkuvõte
Selles tunnis käsitlesite teemat „Alkeenid. Keemilised omadused - 2. Alkeenide valmistamine ja kasutamine. Tunnis sai süvendada teadmisi alkeenidest, õppida tundma alkeenide keemilisi omadusi, aga ka alkeenide saamise ja kasutamise iseärasusi.
Bibliograafia
1. Rudzitis G.E. Keemia. Üldkeemia alused. 10. klass: õpik õppeasutustele: algtase / G. E. Rudzitis, F.G. Feldman. - 14. trükk. - M.: Haridus, 2012.
2. Keemia. 10. klass. Profiili tase: õpik. üldhariduse jaoks institutsioonid / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin ja teised - M.: Drofa, 2008. - 463 lk.
3. Keemia. 11. klass. Profiili tase: õpik. üldhariduse jaoks institutsioonid / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin ja teised - M.: Drofa, 2010. - 462 lk.
4. Khomchenko G.P., Khomchenko I.G. Keemiaülesannete kogu ülikoolidesse astujatele. - 4. väljaanne - M.: RIA "Uus laine": Kirjastus Umerenkov, 2012. - 278 lk.
Kodutöö
1. Nr 12, 13 (lk 39) Rudzitis G.E., Feldman F.G. Keemia: orgaaniline keemia. 10. klass: õpik õppeasutustele: algtase / G. E. Rudzitis, F.G. Feldman. - 14. trükk. - M.: Haridus, 2012.
2. Mis on etüleeni ja selle homoloogide kvalitatiivne reaktsioon?
3. Propeeni kloorimisel ei saa lisada, kuid asendamine toimub? Millega see seotud on?
Tunni teema: Alkeenid. Alkeenide saamine, keemilised omadused ja kasutamine.
Tunni eesmärgid ja eesmärgid:
- arvestama etüleeni spetsiifilisi keemilisi omadusi ja alkeenide üldisi omadusi;
- süvendada ja konkretiseerida ?-sidemete mõisteid, keemiliste reaktsioonide mehhanisme;
- anda esmaseid ideid polümerisatsioonireaktsioonide ja polümeeride struktuuri kohta;
- analüüsida alkeenide saamise laboratoorseid ja üldtööstuslikke meetodeid;
- jätkuvalt arendada õpikuga töötamise oskust.
Varustus: seade gaaside saamiseks, KMnO 4 lahus, etüülalkohol, kontsentreeritud väävelhape, tikud, piirituslamp, liiv, tabelid "Etüleeni molekuli struktuur", "Alkeenide keemilised põhiomadused", näidisproovid "Polümeerid".
TUNNIDE AJAL
I. Organisatsioonimoment
Jätkame alkeenide homoloogsete seeriate uurimist. Tänapäeval peame kaaluma alkeenide saamismeetodeid, keemilisi omadusi ja rakendusi. Peame iseloomustama kaksiksidemest tulenevaid keemilisi omadusi, saama esmase arusaama polümerisatsioonireaktsioonidest, kaaluma alkeenide saamiseks laboratoorseid ja tööstuslikke meetodeid.
II. Õpilaste teadmiste aktiveerimine
- Milliseid süsivesinikke nimetatakse alkeenideks?
- Millised on nende struktuuri omadused?
- Millises hübriidseisundis on süsinikuaatomid, mis moodustavad alkeeni molekulis kaksiksideme?
Alumine rida: alkeenid erinevad alkaanidest ühe kaksiksideme olemasolu molekulides, mis määrab alkeenide keemiliste omaduste tunnused, nende valmistamise ja kasutamise meetodid.
III. Uue materjali õppimine
1. Alkeenide saamise meetodid
Koostage reaktsioonivõrrandid, mis kinnitavad alkeenide saamise meetodeid
– alkaanide krakkimine C 8 H 18 ––> C 4 H 8 + C4H10; (termiline krakkimine temperatuuril 400-700 o C)
oktaan buteenbutaan
– alkaanide dehüdrogeenimine C 4 H 10 ––> C 4 H 8 + H 2; (t, Ni)
butaanbuteen vesinik
– haloalkaanide dehüdrohalogeenimine C 4 H 9 Cl + KOH ––> C 4 H 8 + KCl + H 2 O;
klorobutaanhüdroksiid buteenkloriid vesi
kaalium kaalium
– dihaloalkaanide dehüdrohalogeenimine 
- alkoholide dehüdratsioon C 2 H 5 OH -> C 2 H 4 + H 2 O (kuumutamisel kontsentreeritud väävelhappe juuresolekul)
Pea meeles!
Dehüdrogeenimise, dehüdratsiooni, dehüdrohalogeenimise ja dehalogeenimise reaktsioonides tuleb meeles pidada, et vesinik eraldub valdavalt vähem hüdrogeenitud süsinikuaatomitest (Zaitsevi reegel, 1875)
2. Alkeenide keemilised omadused
Süsinik-süsinik sideme olemus määrab keemiliste reaktsioonide tüübi, milles orgaanilised ained osalevad. Süsinik-süsinik kaksiksideme olemasolu etüleeni süsivesinike molekulides määrab nende ühendite järgmised omadused:
- kaksiksideme olemasolu võimaldab klassifitseerida alkeenid küllastumata ühenditeks. Nende muundumine küllastunud on võimalik ainult liitumisreaktsioonide tulemusena, mis on olefiinide keemilise käitumise peamine tunnus;
- kaksikside on oluline elektrontiheduse kontsentratsioon, seega on liitumisreaktsioonid oma olemuselt elektrofiilsed;
- kaksikside koosneb ühest - ja ühest -sidemest, mis on üsna kergesti polariseeritav.
Alkeenide keemilisi omadusi iseloomustavad reaktsioonivõrrandid
a) Lisamisreaktsioonid
Pea meeles! Asendusreaktsioonid on iseloomulikud alkaanidele ja kõrgematele tsükloalkaanidele, millel on ainult üksiksidemed, liitumisreaktsioonid on iseloomulikud alkeenidele, dieenidele ja alküünidele, millel on kaksiks- ja kolmiksidemed.

Pea meeles! Võimalikud on järgmised katkestusmehhanismid:
a) kui alkeenid ja reaktiiv on mittepolaarsed ühendid, katkeb -side vaba radikaali moodustumisega:
H 2 C \u003d CH 2 + H: H -> + +
b) kui alkeen ja reaktiiv on polaarsed ühendid, siis sideme katkemine viib ioonide moodustumiseni:
c) ühendades molekulis vesinikuaatomeid sisaldavate reagentide katkemiskohas kinnitub vesinik alati rohkem hüdrogeenitud süsinikuaatomiga (Morkovnikovi reegel, 1869).
- polümerisatsioonireaktsioon nCH 2 = CH 2 ––> n – CH 2 – CH 2 ––> (– CH 2 – CH 2 –) n
eteen polüetüleen
b) oksüdatsioonireaktsioon
Laboratoorsed kogemused. Hankige etüleen ja uurige selle omadusi (juhised õpilase laual)
Etüleeni saamise juhend ja sellega katsed
1. Asetage katseklaasi 2 ml kontsentreeritud väävelhapet, 1 ml alkoholi ja väike kogus liiva.
2. Sulgege katseklaas gaasi väljalasketoruga korgiga ja soojendage seda alkohollambi leegis.
3. Laske väljuv gaas läbi kaaliumpermanganaadi lahuse. Pange tähele lahuse värvimuutust.
4. Süütage gaas gaasitoru otsas. Pöörake tähelepanu leegi värvile.
- Alkeenid põlevad helendava leegiga. (Miks?)
C 2 H 4 + 3O 2 -> 2CO 2 + 2H 2 O (täieliku oksüdatsiooni korral on reaktsiooniproduktideks süsinikdioksiid ja vesi)
Kvalitatiivne reaktsioon: "kerge oksüdatsioon (vesilahuses)"
- alkeenid muudavad värvituks kaaliumpermanganaadi lahuse (Wagneri reaktsioon)
Raskemates tingimustes happelises keskkonnas võivad reaktsiooniproduktideks olla näiteks karboksüülhapped (hapete juuresolekul):
CH 3 - CH \u003d CH 2 + 4 [O] -> CH 3 COOH + HCOOH
- katalüütiline oksüdatsioon
Pea meeles peamine!
1. Küllastumata süsivesinikud osalevad aktiivselt liitumisreaktsioonides.
2. Alkeenide reaktsioonivõime tuleneb sellest, et - side puruneb kergesti reagentide toimel.
3. Lisamise tulemusena toimub süsinikuaatomite üleminek sp 2 -st sp 3 - hübriidolekusse. Reaktsiooniproduktil on piirav iseloom.
4. Kui etüleeni, propüleeni ja teisi alkeene kuumutatakse rõhu all või katalüsaatori juuresolekul, ühendatakse nende üksikud molekulid pikkadeks ahelateks – polümeerideks. Polümeerid (polüetüleen, polüpropüleen) omavad suurt praktilist tähtsust.
3. Alkeenide kasutamine(õpilase sõnum järgmise kava järgi).
1 - kõrge oktaanarvuga kütuse saamine;
2 - plastid;
3 - lõhkeained;
4 - antifriis;
5 - lahustid;
6 - puuviljade küpsemise kiirendamiseks;
7 - atseetaldehüüdi saamine;
8 - sünteetiline kautšuk.
III. Õpitud materjali koondamine

Kodutöö:§§ 15, 16, v.a. 1, 2, 3 lk 90, eks. 4, 5 lk 95.
Orgaanilises keemias võib leida süsivesinikaineid, mille ahelas on erinev süsiniku kogus ja C=C side. Need on homoloogid ja neid nimetatakse alkeenideks. Oma struktuuri tõttu on nad keemiliselt reaktiivsemad kui alkaanid. Aga millised on nende reaktsioonid? Mõelge nende levikule looduses, erinevatele hankimis- ja rakendusmeetoditele.
Mis need on?
Alkeenid, mida nimetatakse ka olefiinideks (õlisteks), on saanud oma nime eteenkloriidi järgi, mis on selle rühma esimese liikme derivaat. Kõigil alkeenidel on vähemalt üks C=C kaksikside. C n H 2n on kõigi olefiinide valem ja nimi on moodustatud alkaanist, mille molekulis on sama arv süsinikke, ainult järelliide -an muutub -eeniks. Araabia number nime lõpus läbi sidekriipsu näitab süsiniku numbrit, millest kaksikside algab. Mõelge peamistele alkeenidele, tabel aitab teil neid meeles pidada:
Kui molekulid on lihtsa hargnemata struktuuriga, siis lisatakse järelliide -üleen, see kajastub ka tabelis.
Kust neid leida võib?
Kuna alkeenide reaktsioonivõime on väga kõrge, on nende esindajad looduses äärmiselt haruldased. Olefiini molekuli elupõhimõte on "olgem sõbrad". Muid aineid ümberringi pole - see pole oluline, me oleme üksteisega sõbrad, moodustades polümeere.
Kuid need on olemas ja väike arv esindajaid sisaldub kaasnevas naftagaasis ja suuremad on Kanadas toodetud naftas.
Alkeenide kõige esimene esindaja, eteen, on hormoon, mis stimuleerib puuviljade valmimist, seetõttu sünteesivad taimestiku esindajad seda väikestes kogustes. Seal on alkeen cis-9-trikooseen, mis emastel toakärbestel täidab seksuaalse atraktandi rolli. Seda nimetatakse ka Muscaluriks. (Atraktant – loodusliku või sünteetilise päritoluga aine, mis tekitab teises organismis tõmmet lõhna allika poole). Keemia seisukohast näeb see alkeen välja järgmine:
Kuna kõik alkeenid on väga väärtuslikud toorained, on nende kunstliku saamise meetodid väga mitmekesised. Vaatleme kõige levinumat.
Mis siis, kui vajate palju?
Tööstuses saadakse alkeenide klass peamiselt krakkimise teel, s.o. molekuli lõhenemine kõrgete temperatuuride, kõrgemate alkaanide mõjul. Reaktsioon nõuab kuumutamist vahemikus 400 kuni 700 °C. Alkaan lõheneb vastavalt oma soovile, moodustades alkeene, mille saamise meetodeid me kaalume, koos suure hulga molekulide struktuuri variantidega:
C7H16 -> CH3-CH \u003d CH2 + C4H10.
Teist levinud meetodit nimetatakse dehüdrogeenimiseks, mille käigus vesiniku molekul eraldatakse alkaani seeria esindajast katalüsaatori juuresolekul.
Laboritingimustes on alkeenid ja valmistamismeetodid erinevad, need põhinevad eliminatsioonireaktsioonidel (aatomirühma elimineerimine neid asendamata). Kõige sagedamini eemaldatakse veeaatomid alkoholidest, halogeenidest, vesinikust või vesinikhalogeniididest. Kõige tavalisem viis alkeenide saamiseks on alkoholidest happe kui katalüsaatori juuresolekul. Võimalik on kasutada ka teisi katalüsaatoreid
Kõik eliminatsioonireaktsioonid alluvad Zaitsevi reeglile, mis ütleb:
Vesinikuaatom eraldatakse süsinikust, mis külgneb süsinikuga, mis kannab rühma -OH, milles on vähem vesinikke.

Vastake reeglit rakendades, milline reaktsioonisaadus jääb domineerima? Hiljem saad teada, kas vastasid õigesti.
Keemilised omadused
Alkeenid reageerivad aktiivselt ainetega, purustades nende pi-sideme (teine nimi C=C sidemele). Lõppude lõpuks pole see nii tugev kui üksik (sigma side). Küllastumata süsivesinik muutub pärast reaktsiooni (lisamist) küllastunud süsivesinikuks, ilma et tekiks muid aineid.
- vesiniku lisamine (hüdrogeenimine). Selle läbimiseks on vaja katalüsaatori olemasolu ja kuumutamist;
- halogeeni molekulide lisamine (halogeenimine). See on üks kvalitatiivsetest reaktsioonidest pi-sidemele. Lõppude lõpuks, kui alkeenid reageerivad broomiveega, muutub see pruunist läbipaistvaks;
- reaktsioon vesinikhalogeniididega (hüdrohalogeenimine);
- vee lisamine (hüdratsioon). Reaktsioonitingimused on kuumutamine ja katalüsaatori (happe) olemasolu;
Asümmeetriliste olefiinide reaktsioonid vesinikhalogeniidide ja veega järgivad Markovnikovi reeglit. See tähendab, et vesinik liitub selle süsinikuga süsinik-süsinik kaksiksidemest, millel on juba rohkem vesinikuaatomeid.

- põlemine;
- osalise oksüdatsiooni katalüütiline. Toode on tsüklilised oksiidid;
- Wagneri reaktsioon (oksüdatsioon permanganaadiga neutraalses keskkonnas). See alkeenireaktsioon on veel üks kõrge kvaliteediga C=C side. Voolamisel kaaliumpermanganaadi roosa lahus värvub. Kui sama reaktsioon viiakse läbi kombineeritud happelises keskkonnas, on tooted erinevad (karboksüülhapped, ketoonid, süsinikdioksiid);
- isomerisatsioon. Iseloomulikud on kõik tüübid: cis- ja trans-, kaksiksideme liikumine, tsüklistumine, skeleti isomerisatsioon;
- polümerisatsioon on olefiinide peamine omadus tööstuses.
Rakendus meditsiinis
Alkeenide reaktsiooniproduktidel on suur praktiline tähtsus. Paljusid neist kasutatakse meditsiinis. Glütseriini saadakse propeenist. See mitmehüdroksüülne alkohol on suurepärane lahusti ja kui seda kasutatakse vee asemel, on lahused kontsentreeritumad. Meditsiinilistel eesmärkidel lahustatakse selles alkaloide, tümooli, joodi, broomi jm.Glütseriini kasutatakse ka salvide, pastade ja kreemide valmistamisel. See hoiab ära nende kuivamise. Iseenesest on glütseriin antiseptiline.
Vesinikkloriidiga reageerimisel saadakse derivaadid, mida kasutatakse nahale kandmisel kohaliku tuimestusena, samuti lühiajaliseks anesteesiaks väikeste kirurgiliste sekkumistega, kasutades inhalatsiooni.

Alkadieenid on alkeenid, mille ühes molekulis on kaks kaksiksidet. Nende põhiliseks kasutusalaks on sünteetilise kummi tootmine, millest valmistatakse siis erinevaid soojenduspatju ja süstlaid, sonde ja kateetreid, kindaid, nibusid ja palju muud, mis on haigete eest hoolitsemisel lihtsalt asendamatu.
Rakendus tööstuses
| Tööstuse tüüp | Mida kasutatakse | Kuidas nad saavad kasutada |
| Põllumajandus | eteen | kiirendab puu- ja juurviljade valmimist, taimede defoliatsiooni, kasvuhoonete kiled |
| Lako-värviline | eteen, buteen, propeen jne. | lahustite, eetrite, lahusti saamiseks |
| masinaehitus | 2-metüülpropeen, eteen | sünteetilise kummi tootmine, määrdeõlid, antifriis |
| toidutööstus | eteen | tefloni, etüülalkoholi, äädikhappe tootmine |
| Keemiatööstus | eteen, polüpropüleen | hankida alkohole, polümeere (polüvinüülkloriid, polüetüleen, polüvinüülatsetaat, polüisobtüleen, atsetaldehüüd |
| Kaevandamine | eteen jne. | lõhkeained |
Alkeenid ja nende derivaadid on leidnud tööstuses laiemat rakendust. (Kus ja kuidas alkeene kasutatakse, ülaltoodud tabel).

See on vaid väike osa alkeenide ja nende derivaatide kasutamisest. Iga aastaga vajadus olefiinide järele ainult suureneb, mis tähendab, et suureneb ka vajadus nende tootmiseks.
- Irratsionaalsed väljendid (avaldised juurtega) ja nende teisendamine
- Saltõkov-Štšedrin M teose "Lugu sellest, kuidas üks mees toitis kahte kindralit" ümberjutustus
- Vassili Ermolajevitš Bugor oli Arktika meresõitja ja üks Siberi teerajajaid
- Areeni isomeerid. Areenimolekulide struktuur. σ-kompleksi stabiliseerumine. See viiakse läbi prootoni eraldamisega σ-kompleksist aluse abil. Sel juhul katkeva kovalentse sideme C - H kahe elektroni tõttu taastatakse suletud π-süsteem.
- Millist varustust panna borši 8. tasemele
- M56 Scorpion — VII astme Ameerika tankihävitaja
- Tsingi ja selle ühendite keemilised omadused
- Elusüsteemide elukorralduse tasandid
- Kuidas valmistada heeringast forshmaki Odessas juudi viisil ja uuel viisil Forshmak heeringast klassikaline juudi retsept
- Ameerika kõrvitsapirukas
- Küpsetamiseta kohupiimakook maasikatega
- Salat "seened lume all" Salat "Seened lume all" - samm-sammult retsept koos fotoga
- Šokolaadi purukook küpsised searasvaga
- Kodune suvikõrvitsa kaaviar aeglases pliidis talveks: lihtne ja väga maitsev suvikõrvitsa kaaviar kiire retsept aeglases pliidis
- Lihapirukad pärmitaignast Lihatäidis pirukatele kuidas süüa teha
- Suvikõrvitsapannkoogid Kuidas teha suvikõrvitsapannkooke
- Kuivikud ahjus, temperatuur
- Piparkoogiretseptid täiuslike piparkoogiretseptide jaoks kerge glasuuriga
- Kuidas valmistada suvikõrvitsa kaaviari traditsioonilisel viisil ja aeglases pliidis?
- Loits kohtingul kutsumiseks Loits kohtingule kutsumiseks