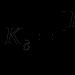Lahendused elektrolüütilise dissotsiatsiooni ioonivahetusreaktsioonid. elektrolüütiline dissotsiatsioon. Ioonivahetusreaktsioonid. Ioonivahetusreaktsioonid
Elektrolüüdid on ained, mis lahuses dissotsieeruvad (lagunevad) ioonideks. Elektrolüütide lahused on võimelised elektrit juhtima. Elektrolüütilise dissotsiatsiooni kvantitatiivseks iseloomustamiseks võeti kasutusele dissotsiatsiooniastme mõiste.
Dissotsiatsiooniaste on ioonideks dissotsieerunud molekulide arvu ja lahustunud aine molekulide koguarvu suhe.
Dissotsiatsiooniastme järgi jagunevad kõik elektrolüüdid tugevateks ja nõrkadeks elektrolüütideks. Tugevate elektrolüütide hulka kuuluvad ühendid, mille dissotsiatsiooniaste on võrdne ühega, need on lahustuvad soolad, leelised ( NaOH, KOH, LiOH, Ca(Oh) 2 ), mõned happed ( TERE, H 2 NII 4 , HCl, HBr, HNO 3 ). Nõrgad elektrolüüdid hõlmavad aineid, mille dissotsiatsiooniaste on palju väiksem kui ühtsus, need on vesi, lahustumatud ja vähelahustuvad soolad, lahustumatud alused, NH 4 Oh, rida happeid ( CH 3 COOH, H 2 NII 3 , HNO 2 , H 2 S, HCN, H 3 PO 4 , H 2 CO 3 , H 2 SiO 3 , HF).
Nõrkade elektrolüütide lahustes kulgeb dissotsiatsiooniprotsess pöörduvalt, seega saab sellele rakendada massimõju seadust. Nii et äädikhappe lahuses on dissotsiatsiooniprotsess pöörduv:
CH 3 COOH CH 3 COO + H
tasakaalukonstant on võrdne:
Dissotsiatsiooniprotsessi tasakaalukonstandit nimetatakse dissotsiatsioonikonstandiks, happesuse konstandiks, aluselisuskonstandiks, happeionisatsioonikonstandiks jne.
Polüaluselised happed dissotsieeruvad etapiviisiliselt ja iga etappi iseloomustab selle dissotsiatsioonikonstant:
H 2 CO 3 H + + HCO 3 -

HCO 3 - H + + CO 3 -

Vesi on ka nõrk elektrolüüt:
H 2 O H + + OH -

Tabelis 1 on toodud mitmete hapete dissotsiatsioonikonstandid, mitmealuseliste hapete dissotsiatsioonikonstandid on esitatud etappidena.
Tabel 1.
|
pealkiri |
valem |
K d |
pK = -lgK d |
|
lämmastikku sisaldav |
HNO 2 |
6,9∙10 −4 |
3,16 |
|
Bornaya |
H3BO3 |
7,1∙10 -10 (K 1) |
9,15 |
|
Tulekivi |
H2SiO3 |
1,3∙10 −10 |
9,9 |
|
väävlis |
H2SO3 |
1,4∙10 −2 |
1,85 |
|
Vesiniksulfiid |
H2S |
1,0∙10 −7 |
6,99 |
|
Kivisüsi |
H2CO3 |
4,5∙10 −7 |
6,35 |
|
ortofosforne |
H3PO4 |
7,1∙10 −3 5,0∙10 −13
|
2,15 12,0 |
|
Vesiniktsüaniid |
HCN |
5,0∙10 −10 |
9,3 |
Ioonivahetusreaktsioonide võrrandite koostamine.
Elektrolüütide lahustes määratakse reaktsioonide suund järgmise reegliga: ioonreaktsioonid kulgevad halvasti lahustuvate ainete, gaaside, nõrkade elektrolüütide ja kompleksioonide tekke suunas, reaktsioonid on praktiliselt pöördumatud. Seda reeglit on lihtne seletada, sest nende reaktsioonide tulemusena eemaldatakse reaktsioonisfäärist üks või mitu iooni, mis vastavalt La Chatelieri põhimõttele viib täielikuma keemilise reaktsioonini.
Sellistel juhtudel on soovitatav kirjutada reaktsioonivõrrandid molekulaar-ioonsel kujul (molekulaarvõrrand, lühendatud ioonvõrrand), mis võimaldab protsessi olemust paremini mõista. Molekulaar-ioonvõrrandites kirjutatakse lahustuvad tugevad elektrolüüdid ioonidena ning nõrgad elektrolüüdid ja halvasti lahustuvad ained molekulide kujul.
Tugevate elektrolüütide koostoime sademe moodustumisega:
Ba 2+ + 2Cl +2H + + SO 4 2 = BaSO 4 + 2H + + 2Cl (täisioonvõrrand)
Ba 2+ + SO 4 2- \u003d BaSO 4 (lühendatud ioonvõrrand)
2) Kahe tugeva elektrolüüdi koosmõju nõrga elektrolüüdi moodustumisega.
KCN + HCl = KCl + HCN
K + + CN + H + + Cl = K + + Cl + HCN
CN + H + = HCN
3) Nõrga elektrolüüdi ja tugeva elektrolüüdi koostoime:
H 2 S + Pb(NO 3) 2 = PbS + 2HNO 3
H 2 S + Pb 2+ + 2NO 3 = PbS + 2H + + 2NO 3
H 2 S + Pb 2+ \u003d PbS + 2H +
Setete koostoime happega:
CaCO 3 + 2H + + 2Cl = Ca 2+ + 2Cl + H 2 O + CO 2
CaCO 3 + 2H + = Ca 2+ + H 2 O + CO 2
Eksperimentaalne osa.
Kogemused 1. Ioonivahetusreaktsioonid sademete tekkega.
Valage kolme katseklaasi 5-6 tilka naatriumfosfaati ja lisage esimesse katseklaasi 5-6 tilka koobaltnitraati, teise katseklaasi 5-6 tilka nikkelsulfaati, kolmandasse 5-6 tilka vasksulfaati. katseklaas. Kirjutage reaktsioonivõrrandid molekulaarsel ja ioonsel kujul.
Valage kahte katseklaasi 5-6 tilka kaaliumdikromaati, esimesse lisage 5-6 tilka baariumkloriidi, teise 5-6 tilka vismutnitraati. Kirjutage reaktsioonivõrrandid molekulaarsel ja ioonsel kujul.
Koostage ioonvõrrandi põhjal molekulaarvõrrand ja viige läbi katse:
Pb 2+ + 2I ─ \u003d PbI 2
3Са 2+ + 2PO 4 3– = Ca 3 (PO 4) 2
Saadaolevate reagentide põhjal saadakse vase-, koobalti- ja nikkelhüdroksiidi sademed. Kirjutage reaktsioonivõrrandid molekulaarsel ja ioonsel kujul.
Kogemus 2. Ioonivahetusreaktsioonid nõrga elektrolüüdi moodustumisega.
Asetage mõned naatriumatsetaadi kristallid katseklaasi ja lisage lahjendatud väävelhape. Kirjutage reaktsioonivõrrandid molekulaarses ja ioonis
Valage katseklaasi paar tilka ammooniumkloriidi ja lisage kaaliumhüdroksiid, määrake lõhna järgi väljuv gaas (kui lõhna pole, võib katseklaasi veidi soojendada). Kirjutage reaktsioonivõrrand molekulaarsel ja ioonsel kujul.
Kogemus 3. Ioonilise tasakaalu nihkumine.
Valage kahte katseklaasi 6-8 tilka ammooniumhüdroksiidi, lisage 2 tilka fenoolftaleiini. Seejärel lisage ühte katseklaasi 1 spaatel ammooniumkloriidi, pange tähele värvi intensiivsuse muutust. Selgitage, kuidas tasakaal lahuses nihkub ammooniumkloriidi lisamisel.
Valage kahte katseklaasi 6-8 tilka äädikhapet, lisage 2 tilka metüülapelsini, lisage ühte katseklaasi 1 spaatliga naatriumatsetaati. Võrrelge värvi intensiivsust katseklaasides. Pange tähele, kuidas soola lisamisel lahuse tasakaal nihkub.
Kogemus 4. Halvasti lahustuvate ainete järjestikuse sadenemise sõltuvus sõltuvalt nende lahustuvusproduktist.
Ühes katseklaasis võtke pliisulfaadi sade, teise pliidikromaadi sade. Märkige moodustunud sademe värvus. Lisage kolmandasse katseklaasi paar tilka kaaliumbikromaati ja naatriumsulfaati, segage lahus ja lisage 2 tilka pliinitraati. Määrake, milline aine sadestub esimesena. Selgitage nende soolade lahustuvuse korrutise põhjal nende sadenemise järjekord.
Õppetund: Elektrolüütiline dissotsiatsioon. Vesiniku indeks. Ioonivahetusreaktsioonid
Eesmärgid:
süstematiseerida õpilaste teadmisi elektrolüütilisest dissotsiatsioonist. Näidake teooria rajajate teaduslikku saavutust. Näidake ainete omaduste sõltuvust nende struktuurist. Viia õpilaste antud teemal omandatud teadmised ühtsesse süsteemi.
Ülesanded:
Täiendada dissotsiatsioonivõrrandite, ioonvõrrandite, hüdrolüüsivõrrandite koostamise oskusi ja oskusi. Moodustada võime ennustada erinevate soolade lahuste keskkonda. Süstematiseerida õpilaste teadmisi orgaaniliste ainete hüdrolüüsist. Arendada oskust jälgida, analüüsida ja järeldusi teha.
Seadmed ja reaktiivid
Kabiin: multimeedia projektor, arvuti.
Tundide ajal
Aja organiseerimine
Põhiteadmiste värskendamine:
Õpilased vastavad kava järgi:
Mis on lahuste elektrijuhtivus?
- Soolade, aluste ja hapete elektrolüütiline dissotsiatsioon.
- Ioonse sidemega ainete elektrolüütilise dissotsiatsiooni mehhanism.
Sissejuhatus uue teema uurimisse:Miks juhivad hapete, soolade ja leeliste lahused elektrit?
Miks on elektrolüüdilahuse keemistemperatuur alati kõrgem kui sama kontsentratsiooniga mitteelektrolüüdi lahuse keemistemperatuur?
Uue materjali õppimine:
1. Elektrolüütilise dissotsiatsiooni mõiste
1887. aastal Rootsi füüsikkeemik Svante Arrhenius, vesilahuste elektrijuhtivust uurides pakkus ta välja, et sellistes lahustes lagunevad ained laetud osakesteks – ioonideks, mis võivad liikuda elektroodidele – negatiivse laenguga katoodiks ja positiivse laenguga anoodiks.
See on lahenduste elektrivoolu põhjus. Seda protsessi nimetatakseelektrolüütiline dissotsiatsioon (sõnasõnaline tõlge - lõhenemine, lagunemine elektri mõjul). See nimi viitab ka sellele, et dissotsiatsioon toimub elektrivoolu toimel. Edasised uuringud näitasid, et see pole nii: ioonid on lahuses ainult laengukandjad ja eksisteerivad selles sõltumata sellest, kas vool läbib lahust või mitte. Svante Arrheniuse aktiivsel osalusel sõnastati elektrolüütilise dissotsiatsiooni teooria, mis on sageli nimetatud selle teadlase järgi. Selle teooria põhiidee seisneb selles, et elektrolüüdid lagunevad lahusti toimel spontaanselt ioonideks. Ja just need ioonid on laengukandjad ja vastutavad lahuse elektrijuhtivuse eest.
Elektrivool on vaba laetud osakeste suunatud liikumine. Teate juba, et soolade ja leeliste lahused ja sulamid on elektrit juhtivad, kuna need ei koosne neutraalsetest molekulidest, vaid laetud osakestest - ioonidest. Sulamisel või lahustamisel muutuvad ioonidtasuta elektrilaengu kandjad.
Aine lagunemise protsessi vabadeks ioonideks selle lahustumisel või sulamisel nimetatakse elektrolüütiliseks dissotsiatsiooniks.
2. Soolade elektrolüütilise dissotsiatsiooni protsessi olemus
Elektrolüütilise dissotsiatsiooni olemus seisneb selles, et ioonid muutuvad veemolekuli mõjul vabaks. Joonis 1. Elektrolüüdi ioonideks lagunemise protsess kuvatakse keemilise võrrandi abil. Kirjutame naatriumkloriidi ja kaltsiumbromiidi dissotsiatsioonivõrrandi. Ühe mooli naatriumkloriidi dissotsieerumine tekitab ühe mooli naatriumkatioone ja ühe mooli kloriidianioone.NaCl ⇄ Na+ + Cl-
Ühe mooli kaltsiumbromiidi dissotsiatsioonil tekib üks mooli naatriumkatioone ja kaks mooli bromiidianione.
CaBr2 ⇄ Ca2+ + 2Br-
Pange tähele: kuna võrrandi vasakule küljele on kirjutatud elektriliselt neutraalse osakese valem, peab ioonide kogulaeng olema võrdne nulliga.
Järeldus : soolade dissotsiatsiooni käigus tekivad happejäägi metallikatioonid ja anioonid.
3. Leeliste elektrolüütilise dissotsiatsiooni protsessi olemus
Mõelge leeliste elektrolüütilise dissotsiatsiooni protsessile. Kirjutame dissotsiatsioonivõrrandi kaaliumhüdroksiidi ja baariumhüdroksiidi lahusesse.
Ühe mooli kaaliumhüdroksiidi dissotsieerumine tekitab ühe mooli kaaliumi katioone ja ühe mooli hüdroksiidi anioone.KOH ⇄ K+ + OH-
Ühe mooli baariumhüdroksiidi dissotsiatsioonil tekib üks mooli baariumi katioone ja kaks mooli hüdroksiidi anioone.Ba(OH)2 ⇄ Ba2+ + 2OH-
Järeldus: leeliste elektrolüütilise dissotsiatsiooni käigus tekivad metallikatioonid ja hüdroksiidianioonid.
Vees lahustumatud alused praktiliselt ei läbi elektrolüütilist dissotsiatsiooni, kuna need on vees praktiliselt lahustumatud ja kuumutamisel lagunevad, nii et neid ei saa sulatada.
4. Hapete elektrolüütilise dissotsiatsiooni protsessi olemus
Mõelge hapete elektrolüütilise dissotsiatsiooni protsessile. Happemolekulid moodustuvad polaarse kovalentse sideme kaudu, mis tähendab, et happed ei koosne ioonidest, vaid molekulidest.
Tekib küsimus - kuidas siis hape dissotsieerub, st kuidas tekivad hapetes vaba laenguga osakesed? Selgub, et ioonid tekivad happelahustes just lahustumisel.
Mõelge vesinikkloriidi elektrolüütilise dissotsiatsiooni protsessile vees, kuid selleks kirjutame üles vesinikkloriidi ja vee molekulide struktuuri. Mõlemad molekulid on moodustatud kovalentse polaarse sideme kaudu. Vesinikkloriidi molekulis on elektrontihedus nihkunud klooriaatomile ja veemolekulis - hapnikuaatomile. Veemolekul suudab vesinikkloriidi molekulilt vesinikkatiooni lahti rebida ja tekib hüdroniumkatioon H3O +.
Siis näeb vesinikkloriidi dissotsiatsiooni võrrand välja järgmine:HCl ⇄ H+ + Cl-
5. Hapete astmeline dissotsiatsioon
Väävelhappe astmeline dissotsiatsioon
Mõelge väävelhappe elektrolüütilise dissotsiatsiooni protsessile. Väävelhape dissotsieerub astmeliselt, kahes etapis.
I-I dissotsiatsiooni staadium
Esimeses etapis eraldub üks vesiniku katioon ja moodustub hüdrosulfaadi anioon.
H2SO4 ⇄ H+ + HSO4-
hüdrosulfaadi anioon.
II - I dissotsiatsiooni staadium
Teises etapis toimub hüdrosulfaadi anioonide edasine dissotsiatsioon.HSO4- ⇄ H+ + SO42-
See etapp on pöörduv, see tähendab, et tekkivad sulfaat-ioonid võivad vesinikkatioonid enda külge kinnitada ja muutuda hüdrosulfaat-anioonideks. Seda näitab pöörduvuse märk.
On happeid, mis ei dissotsieeru täielikult isegi esimesel etapil - sellised happed on nõrgad. Näiteks süsihape H2CO3.
Vesinikuindeks iseloomustab vabade vesinikuioonide kontsentratsiooni vees.
Kuvamise mugavuse huvides võeti kasutusele spetsiaalne indikaator, mida nimetatakse pH-ks, mis on vesinikioonide kontsentratsiooni logaritm, mis on võetud vastupidise märgiga, s.o. pH = -log.
Lihtsamalt öeldes määrab pH väärtuse vees sisalduvate H-ioonide kvantitatiivne suhe + ja tema - tekkis vee dissotsiatsiooni käigus. Kui vees on vabade vesinikuioonide sisaldus (pH> 7) võrreldes OH-ioonidega vähenenud - , siis toimub vees leeliseline reaktsioon ja suurenenud H-ioonide sisaldus + (pH<7)- кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
Peegeldus: koosta cinquain
D/W:
Õppetunni kokkuvõte
Selles õppetükis õppisite, et hapete, soolade ja leeliste lahused on elektrit juhtivad, kuna nende lahustumisel tekivad laetud osakesed - ioonid. Seda protsessi nimetatakse elektrolüütiliseks dissotsiatsiooniks. Soolade dissotsiatsiooni käigus tekivad metallikatioonid ja happeliste jääkide anioonid. Leeliste dissotsiatsiooni käigus tekivad metallikatioonid ja hüdroksiidianioonid. Hapete dissotsiatsiooni käigus tekivad happejäägi vesinikkatioonid ja anioonid.
Elektrolüütiline dissotsiatsioon- elektrolüüdi ioonideks lagunemise protsess selle lahustumisel või sulamisel.
Elektrolüütilise dissotsiatsiooni klassikalise teooria lõid S. Arrhenius ja W. Ostwald 1887. aastal. Arrhenius järgis lahuste füüsikalist teooriat, ei võtnud arvesse elektrolüüdi interaktsiooni veega ja uskus, et lahustes on vabu ioone. Vene keemikud I. A. Kablukov ja V. A. Kistjakovski kasutasid D. I. Mendelejevi lahuste keemilist teooriat elektrolüütilise dissotsiatsiooni selgitamiseks ja tõestasid, et elektrolüüdi lahustumisel interakteerub see keemiliselt veega, mille tulemusena elektrolüüt dissotsieerub ioonideks.
Klassikaline elektrolüütilise dissotsiatsiooni teooria põhineb lahustunud aine mittetäieliku dissotsiatsiooni eeldusel, mida iseloomustab dissotsiatsiooniaste α, st lagunenud elektrolüüdi molekulide osakaal. Dünaamilist tasakaalu dissotsieerumata molekulide ja ioonide vahel kirjeldab massi toime seadus.
Aineid, mis lagunevad ioonideks, nimetatakse elektrolüütideks. Elektrolüüdid on ioonse või tugevalt kovalentse sidemega ained: happed, alused, soolad. muud ained ei ole elektrolüüdid; nende hulka kuuluvad mittepolaarsete või nõrgalt polaarsete kovalentsete sidemetega ained; näiteks paljud orgaanilised ühendid.
TED (elektrolüütilise dissotsiatsiooni teooria) põhisätted:
Molekulid lagunevad positiivselt ja negatiivselt laetud ioonideks (lihtsad ja keerulised).
Elektrivoolu mõjul liiguvad katioonid (positiivselt laetud ioonid katoodi suunas (-) ja anioonid (negatiivselt laetud ioonid) anoodi suunas (+)
Dissotsiatsiooniaste oleneb aine ja lahusti olemusest, kontsentratsioonist, temperatuurist.
Kui dissotsiatsiooni aste sõltub aine olemusest, siis võib otsustada, et teatud ainerühmade vahel on vahe.
Tugevatele elektrolüütidele (enamik aluseid, sooli, palju happeid) on omane suur dissotsiatsiooniaste. Tasub arvestada, et ioonideks lagunemine on pöörduv reaktsioon. Samuti tasub öelda, et topelt- ja aluseliste soolade dissotsiatsiooni näiteid selles teemas ei analüüsita, nende dissotsiatsiooni kirjeldatakse teemas “sool”.
Tugevate elektrolüütide näited:
NaOH, K2SO4, HClO4
Dissotsiatsioonivõrrandid:
NaOH⇄Na + +OH -
K 2 SO 4 ⇄ 2 K + + SO 4 2-
HClO 4 ⇄H + +ClO 4 -
Elektrolüütide tugevuse kvantitatiivne tunnus on dissotsiatsiooniaste (α) - dissotsieerunud elektrolüüdi molaarse kontsentratsiooni suhe selle kogu molaarsesse kontsentratsiooni lahuses.
Dissotsiatsiooniastet väljendatakse ühiku murdosades või protsentides. Väärtuste vahemik on 0 kuni 100%.
α = 0% viitab mitteelektrolüütidele (dissotsiatsioon puudub)
0% <α < 100% относится к слабым электролитам (диссоциация неполная)
α = 100% viitab tugevatele elektrolüütidele (täielik dissotsiatsioon)
Samuti tasub meeles pidada dissotsiatsioonisammude arvu, näiteks:
H 2 SO 4 lahuse dissotsiatsioon
H 2 SO 4 ⇄ H + + HSO 4 -
HSO 4 - ⇄ H + + SO 4 2-
Igal dissotsiatsiooniastmel on oma dissotsiatsiooniaste.
Näiteks soolade CuCl 2, HgCl 2 dissotsiatsioon:
CuCl 2 ⇄Cu 2+ + 2Cl - dissotsiatsioon toimub täielikult
Ja elavhõbekloriidi puhul on dissotsiatsioon mittetäielik ja siis mitte täielikult.
HgCl 2 ⇄HgCl + +Cl -
Tulles tagasi väävelhappe lahuse juurde, tasub öelda, et lahjendatud happe mõlema etapi dissotsiatsiooniaste on palju suurem kui kontsentreeritud happe oma. Kontsentreeritud lahuse dissotsiatsiooni käigus tekib palju ainemolekule ja kõrge kontsentratsiooniga HSO 4 - hüdroanione.
Mitmealuseliste hapete ja polühappealuste puhul toimub dissotsiatsioon mitmes etapis (olenevalt aluselisusest).
Loetleme tugevad ja nõrgad happed ning jätkame ioonivahetuse võrranditega:
Tugevad happed (HCl, HBr, HI, HClO 3, HBrO 3, HIO 3, HClO 4, H 2 SO 4, H 2 SeO 4, HNO 3, HMnO 4, H 2 Cr 2 O 7)
Nõrgad happed (HF, H 2 S, H 2 Se, HClO, HBrO, H 2 SeO 3, HNO 2, H 3 PO 4, H 4 SiO 4, HCN, H 2 CO 3, CH 3 COOH)
Elektrolüütide lahustes ja sulamites toimuvad keemilised reaktsioonid ioonide osalusel. Sellistes reaktsioonides elementide oksüdatsiooniastmed ei muutu ja reaktsioone endid nimetatakse ioonivahetusreaktsioonid.
Ioonivahetusreaktsioonid kulgevad lõpule (pöördumatult), kui tekivad halvasti lahustuvad või praktiliselt lahustumatud ained (sadenevad), lenduvad ained (eralduvad gaasidena) või nõrgad elektrolüüdid (näiteks vesi).
Ioonivahetusreaktsioonid kirjutatakse tavaliselt kolmes etapis:
1. Molekulaarvõrrand
2. Täielik ioonvõrrand
3. Redutseeritud ioonvõrrand
Kirjutamisel tuleb kindlasti märkida sademed ja gaasid, samuti juhinduda lahustuvuse tabelist.
Reaktsioonid, kus kõik reagendid ja saadused on vees lahustuvad, ei toimu.

Mõned näited:
Na 2 CO 3 + H 2 SO 4 → Na 2 SO 4 + CO 2 + H 2 O
2Na + +CO32- +2H + +SO42- →2Na + +SO42- +CO2 +H2O
CO 3 2- + 2H + → CO 2 + H 2 O
Lühendatud ioonvõrrand saadakse täisioonvõrrandi mõlemalt poolt identsete ioonide läbikriipsutamisel.
Kui kahe soola vahel toimub ioonivahetusreaktsioon koos sademe moodustumisega, tuleks võtta kaks hästi lahustuvat reaktiivi. See tähendab, et ioonivahetusreaktsioon kulgeb edasi, kui reagentide lahustuvus on kõrgem kui mõne toote lahustuvus.
Ba(NO 3) 2 + Na 2 SO 4 → BaSO 4 ↓ + 2NaNO 3
Mõnikord jätavad nad ioonivahetusreaktsioone kirjutades vahele täisioonivõrrandi ja kirjutavad kohe lühendatud.
Ba 2+ +SO 4 2- → BaSO 4 ↓
Halvasti lahustuva aine sademe saamiseks on alati vaja valida kontsentreeritud lahustes hästi lahustuvad reaktiivid.
Näiteks:
2KF+FeCl 2 → FeF 2 ↓+2KCl
Fe 2+ +2F - → FeF 2 ↓
Need toodete sadestamiseks kasutatavate reaktiivide valimise reeglid kehtivad ainult soolade jaoks.
Näited reaktsioonidest sademega:
1. Ba(OH) 2 + H 2 SO 4 → BaSO 4 ↓ + 2H 2 O
Ba 2+ +SO 4 2- → BaSO 4 ↓
2. AgNO 3 +KI→AgI↓+KNO 3
Ag + +I - →AgI↓
3.H2S+Pb(NO3)2 →PbS↓+2HNO3
H2S+Pb2+ →PbS↓+2H+
4. 2KOH + FeSO 4 → Fe(OH) 2 ↓ + K 2 SO 4
Fe 2+ +2OH - →Fe(OH) 2 ↓
Näited reaktsioonidest gaaside eraldumisega:
1. CaCO 3 + 2HNO 3 → Ca (NO 3) 2 + CO 2 + H 2 O
CaCO 3 + 2H + → Ca 2+ + CO 2 + H 2 O
2. 2NH4Cl + Ca (OH)2 → 2NH3 + CaCl2 + 2H2O
NH4 + +OH - →NH3 +H2O
3. ZnS+2HCl→H 2 S+ZnCl 2
ZnS+2H+ →H2S+Zn2+
Näited reaktsioonidest nõrkade elektrolüütide moodustumisega:
1.Mg (CH 3 COO) 2 + H 2 SO 4 → MgSO 4 + 2CH 3 COOH
CH3COO - + H + →CH3COOH
2. HI+NaOH→NaI+H 2 O
H + +OH - → H2O
Kaaluge uuritud materjali rakendamist konkreetsete eksamitel esinevate ülesannete jaoks:
№1
.Ainetest: NaCl, Na 2 S, Na 2 SO 4 - reageerib Cu lahusega (NO3) 2 siseneb (-s)
1) ainult Na2S
2) NaCl ja Na2S
3) Na2S ja Na2SO4
4) NaCl ja Na2SO4
Sõna "sisenemine" tähendab "reaktsioon kulgeb" ja nagu eespool mainitud, toimub reaktsioon, kui moodustub lahustumatu või vähelahustuv aine, eraldub gaas või moodustub nõrk elektrolüüt (vesi).
Vaatame valikud ükshaaval läbi.
1) Tekkis Cu(NO 3) 2 +Na 2 S→CuS↓+2NaNO 3 sade.
2) NaCl + Cu (NO 3) 2 ↛CuCl 2 + 2NaNO 3
Ainult reaktsioon Na2S-ga toimub sademe moodustumisega
3) Na2S korral tekib samuti sade, nagu kahes esimeses näites.
Na 2 SO 4 + Cu(NO 3) 2 ↛CuSO 4 + 2NaNO 3
Kõik tooted on hästi lahustuvad elektrolüüdid, nad ei ole gaasid, mistõttu reaktsioon ei toimu.
4) Na 2 SO 4-ga ei kulge reaktsioon nagu eelmises vastuses
NaCl+Cu(NO 3) 2 ↛CuCl 2 +2NaNO 3
Kõik tooted on hästi lahustuvad elektrolüüdid, nad ei ole gaasid, mistõttu reaktsioon ei toimu.
Seetõttu sobib 1 Võimalik vastus.
№2 . Gaas eraldub interaktsiooni käigus
1) MgCl 2 ja Ba (NO 3) 2
2) Na 2 CO 3 ja CaCl 2
3) NH 4 C ja NaOH
4) CuSO4 ja KOH
Sõna "gaas" tähendab sellistes ülesannetes täpselt gaase ja lenduvaid ühendeid.
Ülesannetes leitakse selliste ühenditena tavaliselt NH 3 H 2 O, H 2 CO 3 (tavalistes reaktsioonitingimustes laguneb see CO 2 -ks ja H 2 O-ks, süsihappe täisvalemit on tavaks mitte kirjutada, vaid kohe värvige see gaasi ja vette) , H 2 S.
Eespool toodud ainetest ei saa me H 2 S kätte, kuna kõigis ainetes pole sulfiidiioone. Samuti ei saa me süsihappegaasi kätte, sest selle soolast saamiseks tuleb lisada hapet ja naatriumkarbonaadiga paaritatakse teine sool.
Gaasi saame 3 variandi vahel.
NH 4 Cl + NaOH → NH 3 + NaCl + H 2 O
Eraldi terava lõhnaga gaas.
Seetõttu sobib 3 Võimalik vastus.
№3 .Reageerib vesinikkloriidhappega
1) hõbenitraat
2) baariumnitraat
3) hõbe
4) ränioksiid
Reaktiivide hulgas on kaks elektrolüüti, reaktsiooni toimumiseks on vaja, et sade paistaks silma.
Vesinikkloriidhape ei reageeri ränioksiidiga ja hõbe ei tõrju vesinikkloriidhappest välja.
Ba (NO 3) 2 + 2HCl → BaCl 2 + 2HNO 3 reaktsioon ei toimu, kuna kõik saadused on lahustuvad elektrolüüdid
AgNO 3 + HCl → AgCl↓ + NaNO 3
Välja kukub valge juustune hõbenitraadi sade
Seetõttu sobib 1
Võimalik vastus.
Järgmine ülesande näide, erinevalt esimesest kolmest, on võetud rakendusest KIM USE 2017.
Esimesed kolm on võetud KIM OGE 2017-st
Looge vastavus ainete valemite ja reaktiivi vahel, mille abil saate nende vesilahuseid eristada: iga tähega tähistatud positsiooni jaoks valige vastav numbriga tähistatud asend.
AINEVALEMID REAGENT
A) HNO 3 ja H 2 O 1) CaCO 3
B) KCl ja NaOH 2) KOH
B) NaCl ja BaCl2 3) HCl
D) AlCl 3 ja MgCl 2 4) KNO 3
Selle ülesande täitmiseks peate esmalt mõistma, et iga tähe all on märgitud kaks ainet, mis on samas lahuses ja peate valima aine nii, et vähemalt üks neist reageerib kvalitatiivselt reaktiivainega, mis on antud. numbri all.
Lisage lämmastikhappe lahusele kaltsiumkarbonaat, süsinikdioksiid muutub reaktsiooni märgiks:
2HNO 3 + CaCO 3 → Ca (NO 3) 2 + CO 2 + H 2 O
Samuti loogiliselt võttes ei lahustu kaltsiumkarbonaat vees, mis tähendab, et see ei lahustu ka kõigis teistes lahustes, mistõttu võib reaktsiooni tunnustele lisaks gaasi eraldumisele lisada ka kaltsiumkarbonaadi lahustumist.
B-tähe all olevat lahust saab eristada vesinikkloriidhappega numbri 3 all, kuid ainult siis, kui lubataks kasutada indikaatorit (fenoolftaleiin), mis pärast reaktsiooni värvust kaotaks, kuna leelis neutraliseerub .
Seetõttu saame OH lahuses eristada iooni ainult 5 lahuse (CuSO 4) abil.
2NaOH+CuSO4 →Cu(OH)2 ↓+Na2SO4
Sinised kristallid tekkisid kahes lahuses.
B-tähe all olevat lahust saab eristada ka reagendi number 5 abil, sest sulfaadiioonid sadestuvad baariumiga ühinedes koheselt valgeks kristalseks sademeks, mis on lahustumatu isegi tugevamate hapete ülejäägis.
BaCl 2 + CuSO 4 → CuCl 2 + BaSO 4 ↓
G-tähe all olevat lahust on lihtne eristada mis tahes leelise abil, sest magneesiumi ja alumiiniumi alused sadestuvad reaktsiooni käigus kohe välja. Leelis on esindatud numbri 2 all
AlCl 3 +3KOH→Al(OH)3 ↓+3KCl
MgCl2 +2KOH→Mg(OH)2↓+2KCl
Toimetaja: Kharlamova Galina Nikolaevna
Elektrolüütiline dissotsiatsioon - see on elektrolüüdi molekulide lagunemise protsess ioonideks polaarsete lahustimolekulide toimel.
elektrolüüdid- Need on ained, mille sulandid või vesilahused juhivad elektrivoolu. Nende hulka kuuluvad hapete lahused, sulandid ning leeliste ja soolade lahused. Mitte-elektrolüüdid on ained, mis ei juhi elektrit. Nende hulgas on palju orgaanilisi aineid.
Nimetatakse elektrolüüte, mis dissotsieeruvad peaaegu täielikult ioonideks tugev; nimetatakse elektrolüüte, mis dissotsieeruvad osaliselt ioonideks nõrk. Dissotsiatsiooni täielikkuse kvantifitseerimiseks võetakse kasutusele dissotsiatsiooniastme mõiste. Dissotsiatsiooni aste elektrolüüdiks nimetatakse ioonideks lagunenud molekulide arvu ja lahuses olevate molekulide koguarvu suhet.
Tavaliselt dissotsiatsiooni aste ( α ) väljendatakse ühiku murdosades või protsentides:
kus n on elektrolüütilise dissotsiatsiooniga osakeste arv;
n 0 on osakeste koguarv lahuses.
Tugevad elektrolüüdid - peaaegu kõik soolad, lahustuvad alused ( NaOH, KOH, Ba(Oh) 2 jne), anorgaanilised happed ( H 2 NII 4 , HCl, HNO 3 , HBr, TERE ja jne) .
Nõrgad elektrolüüdid- lahustumatud alused ja NH 4 Oh, anorgaanilised happed ( H 2 CO 3, , H 2 S, HNO 2, H 3 PO 4 jne), orgaanilised happed ja vesi H 2 O.
Tugevad elektrolüüdid dissotsieeruvad ioonideks peaaegu täielikult (st dissotsiatsiooniprotsess on pöördumatu) ja ühes etapis:
HCl=H + +Cl – H 2 NII 4 = 2H + + NII 4 2–
Nõrgad elektrolüüdid dissotsieeruvad osaliselt (st dissotsiatsiooniprotsess on pöörduv) ja järk-järgult . Näiteks mitmealuseliste hapete puhul eraldatakse igas etapis üks vesinikuioon:
1. H 2 NII 3 ⇄ H + + HSO 3 - 2. HSO 3 - ⇄ H + + NII 3 2-
Seega määrab mitmealuseliste hapete astmete arvu happe aluselisus (vesinikioonide arv) ja polühappealuste astmete arvu määrab aluse happesus (või hüdroksüülrühmade arv). : NH 4
Oh
⇄
NH 4
+
+
Oh –
.
Elektrolüütilise dissotsiatsiooni protsess lõpeb süsteemis keemilise tasakaaluseisundi saavutamisega, mida iseloomustab tasakaalukonstant: 
Elektrolüütilise dissotsiatsiooni protsessi tasakaalukonstanti nimetatakse dissotsiatsioonikonstandiks - TO D. Dissotsiatsioonikonstant sõltub elektrolüüdi olemusest, lahusti olemusest, temperatuurist, kuid ei sõltu elektrolüüdi kontsentratsioonist.
vahel TO D ja α Kvantitatiivne seos on olemas
 (13)
(13)
Suhet (13) nimetatakse Ostwaldi lahjendusseaduseks: nõrga elektrolüüdi dissotsiatsiooniaste suureneb lahuse lahjendamisel.
Nõrkade elektrolüütide puhul, kui α 1, TO D = α 2 KOOS.
Vesi on nõrk elektrolüüt, seetõttu dissotsieerub see pöörduvalt:
H 2 O ⇄ H + + Oh – ∆ H\u003d + 56,5 kJ / mol
Vee dissotsiatsioonikonstant: 
Vee dissotsiatsiooniaste on väga väike (see on väga nõrk elektrolüüt). Kuna vett esineb suures liias, võib selle kontsentratsiooni pidada konstantseks väärtuseks ja see on  , siis
, siis
TO D [ H 2 O] = [ H + ]∙[ Oh - ] = 55,6∙1,8∙10 -16 = 10 -14
[ H + ]∙[ Oh - ] = 10 -14 = K W on vee ioonne saadus
Kuna vesiniku katioonide ja hüdroksiidioonide kontsentratsioonid on vees võrdsed, siis: [
H +
]
= [
Oh -
]
=
 .
.
Teiste ainete (hapete, aluste, soolade) lahustumine vees muudab ioonide kontsentratsiooni H + või TEMA – , ja nende korrutis jääb alati konstantseks ja võrdub 10 -14 temperatuuril T \u003d 25 0 C. Ioonide kontsentratsioon H + võib olla lahuse happesuse või aluselisuse mõõt. Tavaliselt kasutatakse selleks pH indikaatorit: pH = - lg[ H + ]. Sellel viisil, pH väärtus on vesinikioonide kontsentratsiooni kümnendlogaritm, mis on võetud vastupidise märgiga.
Sõltuvalt vesinikioonide kontsentratsioonist eristatakse kolme keskkonda.
V neutraalne keskkond [ H + ] = [ Oh - ]= 10 -7 mol/l, pH= –lg 10 -7 = 7 . See keskkond on tüüpiline nii puhta vee kui ka neutraalsete lahuste jaoks. V hapu lahendusi [ H + ] > 10 -7 mol/l, pH< 7 . Happelises keskkonnas pH varieerub sees 0 < рН < 7 . V aluseline keskkondades [ H + ] < [ОН – ] ja [ H + ] < 10 -7 mol/l, seega, pH > 7. PH muutuse piirid: 7 < рН < 14 .
Ioonivahetusreaktsioonid (RIO)- need on reaktsioonid elektrolüütide vesilahustes esinevate ioonide vahel. Vahetusreaktsioonide eripäraks on see, et reagendid moodustavad elemendid ei muuda oma oksüdatsiooniastet. Ioonivahetusreaktsioonid on pöördumatud reaktsioonid ja jätkuvad ette nähtud: 1) halvasti lahustuva aine teke, 2) gaasilise aine eraldumine, 3) nõrga elektrolüüdi teke.
Kui RIO tekib, seotakse vastaslaenguga ioonid ja eemaldatakse reaktsioonisfäärist. Ioonivahetusreaktsioonide olemust väljendatakse ioonvõrrandite abil, mis erinevalt molekulaarsetest näitavad reaktsiooni tõelisi osalejaid. Ioonvõrrandite koostamisel tuleks juhinduda sellest, et kergelt dissotsieeruvad, vähelahustuvad (sadenevad) ja gaasilised ained kirjutatakse molekulaarselt. Tugevalt lahustuvad elektrolüüdid on kirjutatud ioonidena. Seetõttu on ioonvõrrandite kirjutamisel vaja kasutada soolade ja aluste vees lahustuvuse tabelit.
Hüdrolüüs- see on soolaioonide ja veemolekulide interaktsiooni protsess, mis viib vähedissotsieeruvate ühendite moodustumiseni; on ioonivahetusreaktsioonide erijuht. Hüdrolüüsi käigus moodustuvad soolad:
nõrk hape ja tugev alus ( NaCH 3 COO, Na 2 CO 3 , Na 2 S, );
nõrk alus ja tugev hape NH 4 Cl, FeCl 3 , AlCl 3 ,);
nõrk alus ja nõrk hape NH 4 CN, NH 4 CH 3 COO).
Tugeva happe ja tugeva aluse moodustatud soolad ei hüdrolüüsi: Na 2 NII 4 , BaCl 2 , NaCl, NaJ jne.
Soola hüdrolüüs suurendab ioonide kontsentratsiooni H + või TEMA – . See toob kaasa vee ioonilise tasakaalu nihke ja sõltuvalt soola olemusest annab lahusele happelise või aluselise keskkonna (vt probleemide lahendamise näiteid).
Eesmärk. Omandada elektrolüütide lahustes toimuvate reaktsioonide molekulaar- ja ioonvõrrandite koostamise oskused. Õppige määrama ioonreaktsioonide suunda.
Kui mõned ained lahustatakse vees (või muudes polaarsetes lahustites) lahustimolekulide mõjul, lagunevad selle aine molekulid ioonideks. Selle protsessi tulemusena sisaldab lahus mitte ainult lahusti ja lahustunud aine molekule, vaid ka moodustunud ioone. Ainete lahuseid, mis lahustuvad vees või muudes polaarsetes lahustites ioonideks, nimetatakse elektrolüütideks.
Soluudi (elektrolüüdi) molekulide lagunemist ioonideks polaarsete lahustimolekulide toimel nimetatakse elektrolüütiliseks dissotsiatsiooniks.
Elektrolüütide lahused on ioonse elektrijuhtivusega (ioonid osalevad elektrilaengute ülekandes) ja on teist tüüpi juhid.
Lahustunud aine ioonideks lagunemise protsessi kvantitatiivne tunnus on elektrolüütilise dissotsiatsiooni aste - α. Dissotsiatsiooniaste on lahuses (n) ioonideks lagunenud lahustunud aine molekulide arvu suhe lahustunud molekulide koguarvusse (N):
Elektrolüütilise dissotsiatsiooni aste määratakse empiiriliselt ja seda väljendatakse kas ühiku murdosades või protsentides. Elektrolüütide dissotsiatsiooni aste sõltub elektrolüüdi olemusest, kontsentratsioonist ja temperatuurist.
Vastavalt elektrolüütide dissotsiatsiooni astmele lahuses, millel on molaarne kon-
ekvivalentkontsentratsioon 0,1 mol / l (0,1 n.), lahused tingimuslikult
jagatud kolme rühma: tugevad, nõrgad ja keskmised elektrolüüdid. Kui sisse
0,1 N elektrolüüdi lahus α > 0,3 (30 \%) elektrolüüti peetakse tugevaks, α ≤ 0,03 (3 \%) - nõrk elektrolüüt. Keskmise dissotsiatsiooniastmega elektrolüüte peetakse keskmisteks.
Tugevate elektrolüütide suhtes, kui lahustiks on vesi
– happed: НNO3, H2SO4, НCNS, НCl, НClO3, HClO4, HBr, HBrО3, HBrО4, НI, НIO3 HMnO4, H2SeO4, HReO4, HTcO4; samuti happed H2CrO4, H4P2O7, H2S2O6, mis on tugevad dissotsiatsiooni esimeses etapis, st esimese H+ iooni eraldumisel;
– alused: leeliste (Li, Na, K, Rb, Cs, Fr) ja leelismuldmetallide (Ca, Sr, Ba, Ra) hüdroksiidid: LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2 Ba(OH)2, Sr(OH)2; Ra(OH)2; samuti TlOH;
enamik soolasid. Erand: Fe(SCN)3, Mg(CN)2, HgCl2, Hg(CN)2.
Nõrgad elektrolüüdid hõlmavad järgmist:
– happed: H2CO3, HClO, H2S, H3BO3, HCN, H2SO3, H2SiO3, CH3COOH, HCOOH, H2C2O4 jne (lisa, tabel 2);
– alused (р- ja d-elemendid): Be(OH)2, Mg(OH)2, Fe(OH)2, Zn(OH)2; ammooniumhüdroksiid NH4OH, samuti orgaanilised alused – amiinid (CH3NH2) ja amfolüüdid (H3N+CH2COOˉ).
Vesi on väga nõrk elektrolüüt (H2O) α = 2 10-9, s.o.
veemolekulid võivad molekulide omavahelise vastasmõju tõttu ka ioonideks laguneda.
Tugevad elektrolüüdid on ained, mis vees lahustumisel lagunevad täielikult ioonideks, s.t dissotsieeruvad peaaegu täielikult. Pärast elektrolüüdi molekulis olevate ioonide vahelise sideme katkemist veemolekulide toimel ümbritsevad moodustunud ioonid end veemolekulidega ja on seetõttu lahuses hüdraatunud olekus. Võttes arvesse ioonide hüdratatsiooni, võib elektrolüütilise dissotsiatsiooni võrrandi kirjutada järgmiselt:
|
|
Tugeva elektrolüüdi dissotsiatsioonivõrrand on kirjutatud lihtsustatud viisil,
Näiteks:
NaCl → Na+ + Clˉ;
HNO3 → H+ + NO3ˉ;
Ba(OH)2 → Ba2+ + 2OHˉ
Nõrgad elektrolüüdid hõlmavad aineid, mis vees lahustumisel dissotsieeruvad osaliselt ioonideks. Tasakaal luuakse ioonide, mille kontsentratsioon lahuses on madal, ja tegelikult olemasolevate mittedissotsieerunud molekulide vahel:
CH3COOH ⇄ CH3COOˉ + H+; H2O ⇄ H+ + OHˉ.
See tähistus tähendab, et lahenduses toimub korraga kaks protsessi.
protsess: molekulide lagunemine ioonideks ja molekulide moodustumine ioonidest. Nõrkade elektrolüütide lahuste tasakaal nihkub lähteproduktide suunas, seetõttu esinevad nõrgad elektrolüüdid lahuses peamiselt molekulide kujul.
Elektrolüütide lahuste keemilised omadused sõltuvad lahuses olevate ioonide ja molekulide omadustest. Ioonide ja molekulide vaheliste reaktsioonide suuna elektrolüütide lahustes määrab halvasti lahustuvate ainete või nõrkade elektrolüütide moodustumise võimalus. Kui reaktsiooni tulemusena ei moodustu halvasti lahustuv aine või nõrk elektrolüüt, siis selline reaktsioon ei saa toimuda. Näiteks kui valatakse naatriumnitraadi ja kaaliumkloriidi lahused, siis reaktsioon ei kulge, kuna vahetusreaktsiooni käigus ei saa lahuses olevatest ioonidest tekkida halvasti lahustuvat ainet ega nõrka elektrolüüti. Need soolad on tugevad elektrolüüdid ja vees hästi lahustuvad, nii et lahus sisaldab
ioonide segu:
Na+ + NO3ˉ + K+ + Clˉ,
millest algsed ained koosnesid. Seetõttu on sel juhul võimatu kirjutada vahetusreaktsiooni molekulaarvõrrandit
NaNO3 + KCl ≠ KNO3 + NaCl.
Lahuses toimuvat reaktsiooni võib kujutada järgmiselt:
Molekulaarreaktsiooni võrrand;
Ioon-molekulaarvõrrand (täis- või taandatud).
Reaktsioonivõrrandit, mis sisaldab ainult dissotsieerumata ainete valemeid, nimetatakse molekulaarvõrrandiks. Võrrandi molekulaarne vorm näitab, millised ained ja millises koguses reaktsioonis osalevad. See võimaldab teil teha selle reaktsiooniga seotud vajalikke arvutusi. Võrrandit, mis sisaldab dissotsieerumata nõrkade elektrolüütide ja tugevate elektrolüütide ioonide valemeid, nimetatakse täielikuks ioonse või ioon-molekulaarse reaktsiooni võrrandiks.
Redutseerides samad produktid ioon-molekulaarse reaktsiooni võrrandi vasakus ja paremas osas, saame lühendatud või lühikese ioonreaktsiooni võrrandi. Ioonvõrrandit, mis ei sisalda reaktsiooni vasakus ja paremas osas samu aineid (ioone või molekule), nimetatakse taandatud või lühikeseks ioonreaktsiooni võrrandiks. See võrrand peegeldab toimuva reaktsiooni olemust.
Ioonreaktsiooni võrrandite kirjutamisel peate meeles pidama:
1) tugevad elektrolüüdid tuleks kirjutada eraldi
ioonid, mis neid moodustavad;
2) nõrgad elektrolüüdid ja halvasti lahustuvad ained tuleks üles kirjutada
moodustuma molekulide kujul.
Näiteks kaaluge sooda koostoimet happega. Molekulaarreaktsiooni võrrandis on lähteained ja reaktsiooniproduktid kirjutatud molekulide kujul:
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O.
Võttes arvesse, et vesilahuses on elektrolüütilise aine molekulid
ioonid lagunevad ioonideks, on selle reaktsiooni täielik ioonvõrrand oma kujul
CO2–Ioonvõrrandis on nõrgad elektrolüüdid, gaasid ja halvasti lahustuvad ained kirjutatud molekulidena. Märk ↓ aine valemis tähendab, et see aine eemaldatakse reaktsioonisfäärist kujul
sete ja tähis tähendab, et aine eemaldatakse reaktsioonisfäärist gaasi kujul.
Ained, mille molekulid dissotsieeruvad täielikult ioonideks (tugevad elektrolüüdid), kirjutatakse ioonideks. Võrrandi vasakul poolel olevate elektrilaengute summa peab olema võrdne paremal pool olevate elektrilaengute summaga.
Ioonvõrrandite kirjutamisel tuleks juhinduda hapete, aluste ja soolade vees lahustuvuse tabelist, st on vaja kontrollida reaktiivide ja saaduste lahustuvust, märkides selle võrrandites, samuti dissotsiatsioonikonstantide tabelist. nõrkade elektrolüütide sisaldus (lisa, tabel 1 ja 2). Vaatleme mõne ioon-molekulaarvõrrandi kirjutamise näiteid.
Näide 1. Raskesti ja vähelahustuvate ühendite moodustumine (sade).
a) baariumsulfaadi moodustumine
Molekulaarse reaktsiooni võrrand:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl.
Täisioonse (ioon-molekulaarse) reaktsiooni võrrand:
Ba2+ + 2Clˉ + 2Na+ + SO4 ˉ = BaSO4↓ + 2Na
CO2–CO2 + H2O (lühendatud ioonvõrrand).
Näide 3. Nõrga elektrolüüdi moodustumine.
2Na+ + 2OH– +2H+ + SO 2–(täisioonvõrrand)
2OH– + 2H+ = 2H2O (lühendatud ioonvõrrand).
Tugeva happe neutraliseerimise reaktsioon tugeva alusega taandub vesinikioonide vastastikmõjule hüdroksiidioonidega;
b) nõrk hape:
2NaNO2 + H2SO4 = 2HNO2 + Na2SO4 (molekulaarne võrrand)
NH+(täisioonvõrrand)
NH4OH (lühendatud ioonvõrrand).
Tugevad alused tõrjuvad nõrgad alused oma sooladest välja.
Näide 4. Kui lähteühendite ja reaktsioonisaaduste hulgas on nõrk elektrolüüt või halvasti lahustuv aine, siis kasutatakse võrrandis
Xia tasakaalumärk "⇄". Tasakaal reaktsioonis nihkub nõrgema elektrolüüdi või halvasti lahustuva aine suunas, mida tähistatakse
ikoon (↷)..
a) CH3COOH + NaOH ⇄ CH3COONa + H2O
CH3COOH + OHˉ ⇄ CH3COOˉ + H2O (↷).
Reaktsiooni tulemusena tekib nõrgem elektrolüüt – vesi. võrdne-
see on nihutatud otsese reaktsiooni suunas.
b) CaSO4↓ + Na2CO3 ⇄ CaCO3↓ + Na2SO4;
|
|
⇄ CaCO3↓ + 2 Na+
Reaktsiooni tulemusena moodustub vähem lahustuv sool - kaltsiumkarbonaat
mine. Tasakaal nihkub otsese reaktsiooni suunas.
Näide 5. Kirjutage kolm võimalikku molekulaarse reaktsiooni võrrandit,
mis vastab taandatud ioonvõrrandile: CH3COO– + H+ = CH3COOH.
Lahendus. Vabad ioonid CH3COO– ja H+ on näidatud ioonvõrrandi vasakul küljel. Need ioonid tekivad lahustuvate tugevate elektrolüütide dissotsiatsiooni käigus. CH3COO– ioonid võivad tekkida näiteks KCH3COO, NaCH3COO, Mg (CH3COO)2 soolade dissotsiatsioonil; joodi doonorid
uus H+ võib olla mis tahes tugev happed. Molekulaarsete reaktsioonide võrrandid,
millele see molekulaar-ioonvõrrand vastab, võib olla:
1. KCH3COO + HCl = CH3COOH + KCl;
2. NaCH3COO + HNO3 = CH3COOH + NaNO3;
3. Mg(CH3COO)2 + H2SO4 = 2 CH3COOH + MgSO4.
Ohutus
1. Olge hapete ja leeliste lahustega töötades eriti ettevaatlik, vältige nende kokkupuudet naha ja riietega.
2. Kui katse käigus eraldub mürgist gaasilist toodet, viige katse kindlasti läbi töötava ventilatsiooniga tõmbekapis.
3. Töötades mürgiste soolade ja nende lahustega (baariumi-, kroomi-, vasesoolad jne) olge ettevaatlik.
- Irratsionaalsed väljendid (avaldised juurtega) ja nende teisendamine
- Saltõkov-Štšedrin M teose "Lugu sellest, kuidas üks mees toitis kahte kindralit" ümberjutustus
- Vassili Ermolajevitš Bugor oli Arktika meresõitja ja üks Siberi teerajajaid
- Areeni isomeerid. Areenimolekulide struktuur. σ-kompleksi stabiliseerumine. See viiakse läbi prootoni eraldamisega σ-kompleksist aluse abil. Sel juhul taastatakse katkendliku kovalentse sideme C - H kahe elektroni tõttu suletud π-süsteem
- Millist varustust panna borši 8. tasemele
- M56 Scorpion — VII astme Ameerika tankihävitaja
- Tsingi ja selle ühendite keemilised omadused
- Elusüsteemide elukorralduse tasandid
- Kuidas valmistada heeringast forshmaki Odessas juudi viisil ja uuel viisil Forshmak heeringast klassikaline juudi retsept
- Ameerika kõrvitsapirukas
- Küpsetamiseta kohupiimakook maasikatega
- Salat "seened lume all" Salat "Seened lume all" - samm-sammult retsept koos fotoga
- Šokolaadi purukook küpsised searasvaga
- Kodune suvikõrvitsa kaaviar aeglases pliidis talveks: lihtne ja väga maitsev suvikõrvitsa kaaviar kiire retsept aeglases pliidis
- Lihapirukad pärmitaignast Lihatäidis pirukatele kuidas süüa teha
- Suvikõrvitsapannkoogid Kuidas teha suvikõrvitsapannkooke
- Kuivikud ahjus, temperatuur
- Piparkoogiretseptid täiuslike piparkoogiretseptide jaoks kerge glasuuriga
- Kuidas valmistada suvikõrvitsa kaaviari traditsioonilisel viisil ja aeglases pliidis?
- Loits kohtingul kutsumiseks Loits kohtingule kutsumiseks