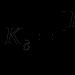Məhlullar elektrolitik dissosiasiya ion mübadiləsi reaksiyaları. elektrolitik dissosiasiya. İon mübadiləsi reaksiyaları. İon mübadiləsi reaksiyaları
Elektrolitlər məhlulda ionlara ayrılan (parçalanan) maddələrdir. Elektrolit məhlulları elektrik cərəyanını keçirməyə qadirdir. Elektrolitik dissosiasiyanı kəmiyyətcə xarakterizə etmək üçün dissosiasiya dərəcəsi anlayışı təqdim edilmişdir.
Dissosiasiya dərəcəsi ionlara dissosiasiya olunan molekulların sayının məhlulun ümumi molekullarının sayına nisbətidir.
Dissosiasiya dərəcəsinə görə bütün elektrolitlər güclü və zəif elektrolitlərə bölünür. Güclü elektrolitlərə dissosiasiya dərəcəsi 1-ə bərabər olan birləşmələr daxildir, bunlar həll olunan duzlar, qələvilərdir ( NaOH, KOH, LiOH, Ca(Oh) 2 ), bəzi turşular ( salam, H 2 BELƏ Kİ 4 , HCl, HBr, HNO 3 ). Zəif elektrolitlərə dissosiasiya dərəcəsi vahiddən çox az olan maddələr daxildir, bunlar su, həll olunmayan və az həll olunan duzlar, həll olunmayan əsaslar, NH 4 Oh, bir sıra turşular ( CH 3 COOH, H 2 BELƏ Kİ 3 , HNO 2 , H 2 S, HCN, H 3 PO 4 , H 2 CO 3 , H 2 SiO 3 , HF).
Zəif elektrolitlərin məhlullarında dissosiasiya prosesi tərs gedir, ona görə də kütlənin hərəkət qanununu ona tətbiq etmək olar. Beləliklə, sirkə turşusunun məhlulunda dissosiasiya prosesi geri çevrilir:
CH 3 COOH CH 3 COO + H
tarazlıq sabiti bərabər olacaq:
Dissosiasiya prosesi üçün tarazlıq sabiti dissosiasiya sabiti, turşuluq sabiti, əsaslıq sabiti, turşunun ionlaşma sabiti və s.
Çox əsaslı turşular mərhələlərlə dissosiasiyaya məruz qalır və hər bir mərhələ dissosiasiya sabiti ilə xarakterizə olunur:
H 2 CO 3 H + + HCO 3 -

HCO 3 - H + + CO 3 -

Su da zəif elektrolitdir:
H 2 O H + + OH -

Cədvəl 1 bir sıra turşuların dissosiasiya sabitlərini göstərir, çoxəsaslı turşular üçün dissosiasiya sabitləri mərhələlərlə təqdim olunur.
Cədvəl 1.
|
başlıq |
düstur |
K d |
pK = -lgK d |
|
azotlu |
HNO 2 |
6,9∙10 −4 |
3,16 |
|
Bornaya |
H3BO3 |
7,1∙10 −10 (K 1) |
9,15 |
|
Flint |
H2SiO3 |
1,3∙10 −10 |
9,9 |
|
kükürdlü |
H2SO3 |
1,4∙10 −2 |
1,85 |
|
Hidrogen sulfid |
H 2 S |
1,0∙10 −7 |
6,99 |
|
Kömür |
H2CO3 |
4,5∙10 −7 |
6,35 |
|
ortofosforik |
H3PO4 |
7,1∙10 −3 5,0∙10 −13
|
2,15 12,0 |
|
Hidrogen siyanid |
HCN |
5,0∙10 −10 |
9,3 |
İon mübadiləsi reaksiyalarının tənliklərinin tərtib edilməsi.
Elektrolit məhlullarında reaksiyaların istiqaməti aşağıdakı qayda ilə müəyyən edilir: ion reaksiyaları zəif həll olunan maddələrin, qazların, zəif elektrolitlərin və mürəkkəb ionların əmələ gəlməsinə doğru gedir, reaksiyalar praktiki olaraq geri dönməzdir. Bu qayda asanlıqla izah olunur, çünki bu reaksiyalar nəticəsində reaksiya sferasından bir və ya bir neçə ion çıxarılır ki, bu da La Chatelier prinsipinə uyğun olaraq daha tam kimyəvi reaksiyaya səbəb olur.
Belə hallarda reaksiya tənliklərini molekulyar-ion formasında (molekulyar tənlik, qısaldılmış ion tənliyi) yazmaq tövsiyə olunur ki, bu da prosesin mahiyyətini daha yaxşı başa düşməyə imkan verir. Molekulyar-ion tənliklərində həll olunan güclü elektrolitlər ion şəklində, zəif elektrolitlər və zəif həll olunan maddələr isə molekul şəklində yazılır.
Güclü elektrolitlərin çöküntü əmələ gəlməsi ilə qarşılıqlı təsiri:
Ba 2+ + 2Cl +2H + + SO 4 2 = BaSO 4 + 2H + + 2Cl (tam ion tənliyi)
Ba 2+ + SO 4 2- \u003d BaSO 4 (qısaldılmış ion tənliyi)
2) İki güclü elektrolitin zəif elektrolitin əmələ gəlməsi ilə qarşılıqlı təsiri.
KCN + HCl = KCl + HCN
K + + CN + H + + Cl = K + + Cl + HCN
CN + H + = HCN
3) Zəif elektrolitin güclü ilə qarşılıqlı təsiri:
H 2 S + Pb(NO 3) 2 = PbS + 2HNO 3
H 2 S + Pb 2+ + 2NO 3 = PbS + 2H + + 2NO 3
H 2 S + Pb 2+ \u003d PbS + 2H +
Çöküntünün turşu ilə qarşılıqlı təsiri:
CaCO 3 + 2H + + 2Cl = Ca 2+ + 2Cl + H 2 O + CO 2
CaCO 3 + 2H + = Ca 2+ + H 2 O + CO 2
Eksperimental hissə.
Təcrübə 1. Çöküntülərin əmələ gəlməsi ilə ion mübadiləsi reaksiyaları.
Üç sınaq borusuna 5-6 damcı natrium fosfat töküb birinci probirkaya 5-6 damcı kobalt nitrat, ikinci sınaq borusuna 5-6 damcı nikel sulfat, üçüncüyə 5-6 damcı mis sulfat əlavə edin. sınaq borusu. Reaksiya tənliklərini molekulyar və ion şəklində yazın.
İki probirkaya 5-6 damcı kalium dikromat tökün, birinciyə 5-6 damcı barium xlorid, ikinciyə 5-6 damcı vismut nitrat əlavə edin. Reaksiya tənliklərini molekulyar və ion şəklində yazın.
İon tənliyinə əsaslanaraq molekulyar tənlik qurun və təcrübə aparın:
Pb 2+ + 2I ─ \u003d PbI 2
3Са 2+ + 2PO 4 3– = Ca 3 (PO 4) 2
Mövcud reagentlərə əsasən mis, kobalt və nikel hidroksidlərinin çöküntülərini əldə edin. Reaksiya tənliklərini molekulyar və ion şəklində yazın.
Təcrübə 2. Zəif elektrolitin əmələ gəlməsi ilə ion mübadiləsi reaksiyaları.
Sınaq borusuna bir neçə natrium asetat kristalını qoyun və seyreltilmiş sulfat turşusu əlavə edin. Reaksiya tənliklərini molekulyar və ion şəklində yazın
Probirkaya bir neçə damcı ammonium xlorid tökün və kalium hidroksid əlavə edin, qoxuya görə qaçan qazı təyin edin (əgər qoxu yoxdursa, sınaq borusunu bir qədər isitmək olar). Reaksiya tənliyini molekulyar və ion şəklində yazın.
Təcrübə 3. İon tarazlığının yerdəyişməsi.
İki sınaq borusuna 6-8 damcı ammonium hidroksid tökün, 2 damcı fenolftalein əlavə edin. Sonra sınaq borularından birinə 1 spatula ammonium xlorid əlavə edin, rəng intensivliyinin dəyişməsini qeyd edin. Ammonium xlorid əlavə edildikdə məhluldakı tarazlığın necə dəyişdiyini izah edin.
İki probirkaya 6-8 damcı sirkə turşusu tökün, 2 damcı metil narıncı əlavə edin, sınaq borularından birinə 1 spatula natrium asetat əlavə edin. Sınaq borularındakı rəng intensivliyini müqayisə edin. Duz əlavə edildikdə məhluldakı tarazlığın necə dəyişdiyinə diqqət yetirin.
Təcrübə 4. Zəif həll olunan maddələrin həlledicilik məhsulundan asılı olaraq ardıcıl çökmələrinin asılılığı.
Bir sınaq borusunda qurğuşun sulfat çöküntüsü, ikincisində qurğuşun dikromat çöküntüsü alın. Yaranan çöküntünün rənginə diqqət yetirin. Üçüncü sınaq borusuna bir neçə damcı kalium bixromat və natrium sulfat əlavə edin, məhlulu qarışdırın və 2 damcı qurğuşun nitrat əlavə edin. Əvvəlcə hansı maddənin çökdüyünü müəyyən edin. Bu duzların həll olunma məhsuluna əsaslanaraq, onların çökmə ardıcıllığını izah edin.
Dərs: Elektrolitik dissosiasiya. Hidrogen indeksi. İon mübadiləsi reaksiyaları
Məqsədlər:
tələbələrin elektrolitik dissosiasiya haqqında biliklərini sistemləşdirmək. Nəzəriyyənin banilərinin elmi şücaətlərini göstərin. Maddələrin xassələrinin onların quruluşundan asılılığını göstərin. Şagirdlərin mövzu üzrə əldə etdikləri bilikləri vahid sistemə gətirmək.
Tapşırıqlar:
Dissosiasiya tənliklərini, ion tənliklərini, hidroliz tənliklərini tərtib etmək bacarıq və bacarıqlarını təkmilləşdirmək. Müxtəlif duzların məhlullarının mühitini proqnozlaşdırmaq bacarığını formalaşdırmaq. Şagirdlərin üzvi maddələrin hidrolizi haqqında biliklərini sistemləşdirmək. Müşahidə etmək, təhlil etmək və nəticə çıxarmaq bacarığını inkişaf etdirin.
Avadanlıq və reagentlər
: multimedia proyektoru, kompüter.
Dərslər zamanı
Təşkilat vaxtı
Əsas biliklərin yenilənməsi:
Şagirdlər plana uyğun olaraq cavab verirlər:
Məhlulların elektrik keçiriciliyi nədir?
- Duzların, əsasların və turşuların elektrolitik dissosiasiyası.
- İon rabitəsi olan maddələrin elektrolitik dissosiasiya mexanizmi.
Yeni bir mövzunun öyrənilməsinə giriş:Niyə turşuların, duzların və qələvilərin məhlulları elektrik cərəyanını keçirir?
Niyə elektrolit məhlulunun qaynama nöqtəsi həmişə eyni konsentrasiyalı qeyri-elektrolit məhlulunun qaynama nöqtəsindən yüksək olacaq?
Yeni materialın öyrənilməsi:
1. Elektrolitik dissosiasiya anlayışı
1887-ci ildə isveçli fizikkimyaçı Svante Arrhenius, sulu məhlulların elektrik keçiriciliyini tədqiq edərək, o, belə məhlullarda maddələrin yüklü hissəciklərə - elektrodlara keçə bilən ionlara - mənfi yüklü katod və müsbət yüklü anoda parçalanmasını təklif etdi.
Məhlullarda elektrik cərəyanının səbəbi budur. Bu proses adlanırelektrolitik dissosiasiya (hərfi tərcümə - elektrikin təsiri altında parçalanma, parçalanma). Bu ad həm də dissosiasiyanın elektrik cərəyanının təsiri altında baş verdiyini göstərir. Sonrakı tədqiqatlar göstərdi ki, bu belə deyil: ionlar məhlulda yalnız yük daşıyıcılarıdır və cərəyanın məhluldan keçib-keçməməsindən asılı olmayaraq orada mövcuddurlar. Svante Arrheniusun fəal iştirakı ilə tez-tez bu alimin adını daşıyan elektrolitik dissosiasiya nəzəriyyəsi formalaşdırıldı. Bu nəzəriyyənin əsas ideyası bir həlledicinin təsiri altında elektrolitlərin kortəbii olaraq ionlara parçalanmasıdır. Məhz bu ionlar yük daşıyıcılarıdır və məhlulun elektrik keçiriciliyindən məsuldurlar.
Elektrik cərəyanı sərbəst yüklü hissəciklərin istiqamətləndirilmiş hərəkətidir. Artıq bilirsiniz ki, duzların və qələvilərin məhlulları və ərimələri elektrik keçiricidir, çünki onlar neytral molekullardan deyil, yüklü hissəciklərdən - ionlardan ibarətdir. Ərindikdə və ya həll edildikdə, ionlar olurpulsuz elektrik yükü daşıyıcıları.
Maddənin əriməsi və ya əriməsi zamanı onun sərbəst ionlara parçalanması prosesinə elektrolitik dissosiasiya deyilir.
2. Duzların elektrolitik dissosiasiya prosesinin mahiyyəti
Elektrolitik dissosiasiyanın mahiyyəti ondan ibarətdir ki, ionlar su molekulunun təsiri altında sərbəst olur. Şəkil 1. Elektrolitin ionlara parçalanması prosesi kimyəvi tənlikdən istifadə etməklə göstərilir. Natrium xlorid və kalsium bromid üçün dissosiasiya tənliyini yazaq. Bir mol natrium xloridin dissosiasiyası nəticəsində bir mol natrium kationları və bir mol xlorid anionları əmələ gəlir.NaCl ⇄ Na+ + Cl-
Bir mol kalsium bromidin dissosiasiyası nəticəsində bir mol natrium kationları və iki mol bromid anionları əmələ gəlir.
CaBr2 ⇄ Ca2+ + 2Br-
Diqqət edin: tənliyin sol tərəfində elektrik neytral hissəciyin düsturu yazıldığından ionların ümumi yükü sıfıra bərabər olmalıdır.
Nəticə : duzların dissosiasiyası zamanı turşu qalığının metal kationları və anionları əmələ gəlir.
3. Qələvilərin elektrolitik dissosiasiya prosesinin mahiyyəti
Qələvilərin elektrolitik dissosiasiya prosesini nəzərdən keçirək. Kalium hidroksid və barium hidroksid məhlulunda dissosiasiya tənliyini yazaq.
Bir mol kalium hidroksidinin dissosiasiyası nəticəsində bir mol kalium kationları və bir mol hidroksid anionları əmələ gəlir.KOH ⇄ K+ + OH-
Bir mol barium hidroksidinin dissosiasiyası nəticəsində bir mol barium kationları və iki mol hidroksid anionları əmələ gəlir.Ba(OH)2 ⇄ Ba2+ + 2OH-
Nəticə: qələvilərin elektrolitik dissosiasiyası zamanı metal kationları və hidroksid anionları əmələ gəlir.
Suda həll olunmayan əsaslar praktiki olaraq elektrolitik dissosiasiyaya məruz qalmır, çünki onlar suda praktiki olaraq həll olunmur və qızdırıldıqda əriməməsi üçün parçalanırlar.
4. Turşuların elektrolitik dissosiasiya prosesinin mahiyyəti
Turşuların elektrolitik dissosiasiya prosesini nəzərdən keçirək. Turşu molekulları qütblü kovalent əlaqə ilə əmələ gəlir, yəni turşular ionlardan deyil, molekullardan ibarətdir.
Sual yaranır - onda turşu necə dissosiasiya olunur, yəni turşularda sərbəst yüklü hissəciklər necə əmələ gəlir? Məlum olur ki, ionlar turşu məhlullarında həll olunma zamanı dəqiq əmələ gəlir.
Suda hidrogen xloridin elektrolitik dissosiasiya prosesini nəzərdən keçirək, lakin bunun üçün hidrogen xlorid və su molekullarının quruluşunu yazacağıq. Hər iki molekul kovalent qütb bağı ilə əmələ gəlir. Hidrogen xlorid molekulunda elektron sıxlığı xlor atomuna, su molekulunda isə oksigen atomuna keçir. Su molekulu hidrogen xlorid molekulundan hidrogen kationını qoparmağa qadirdir və hidronium kationı H3O+ əmələ gəlir.
Sonra hidrogen xloridin dissosiasiya tənliyi belə görünür:HCl ⇄ H+ + Cl-
5. Turşuların mərhələli dissosiasiyası
Kükürd turşusunun pilləli dissosiasiyası
Kükürd turşusunun elektrolitik dissosiasiya prosesini nəzərdən keçirək. Kükürd turşusu pilləli, iki mərhələdə dissosiasiya olunur.
I-I dissosiasiya mərhələsi
Birinci mərhələdə bir hidrogen katyonu ayrılır və hidrosulfat anionu əmələ gəlir.
H2SO4 ⇄ H+ + HSO4-
hidrosulfat anion.
II - I dissosiasiya mərhələsi
İkinci mərhələdə hidrosulfat anionlarının daha da dissosiasiyası baş verir.HSO4- ⇄ H+ + SO42-
Bu mərhələ geri çevrilir, yəni yaranan sulfat - ionları hidrogen kationlarını özlərinə birləşdirə və hidrosulfat - anionlara çevrilə bilər. Bu, geri dönmə əlaməti ilə göstərilir.
Elə turşular var ki, hətta birinci mərhələdə tamamilə dissosiasiya olunmur - belə turşular zəifdir. Məsələn, karbon turşusu H2CO3.
Hidrogen indeksi suda sərbəst hidrogen ionlarının konsentrasiyasını xarakterizə edir.
Ekranın rahatlığı üçün, əks işarə ilə alınan hidrogen ionlarının konsentrasiyasının loqarifmi olan pH adlı xüsusi bir göstərici təqdim edildi, yəni. pH = -log.
Sadəcə olaraq, pH dəyəri sudakı H ionlarının kəmiyyət nisbəti ilə müəyyən edilir + və o - suyun dissosiasiyası zamanı əmələ gəlir. Suda OH ionları ilə müqayisədə sərbəst hidrogen ionlarının (pH> 7) azaldılmış tərkibi varsa - , onda su qələvi reaksiyaya sahib olacaq və H ionlarının artan tərkibi ilə + (pH<7)- кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
Refleksiya: sinquain tərtib edin
D/W:
Dərsi yekunlaşdırmaq
Bu dərsdə siz turşuların, duzların və qələvilərin məhlullarının elektrik keçirici olduğunu öyrəndiniz, çünki onlar həll edildikdə yüklü hissəciklər - ionlar əmələ gəlir. Bu proses elektrolitik dissosiasiya adlanır. Duzların dissosiasiyası zamanı turşu qalıqlarının metal kationları və anionları əmələ gəlir. Qələvilərin dissosiasiyası zamanı metal kationları və hidroksid anionları əmələ gəlir. Turşuların dissosiasiyası zamanı turşu qalığının hidrogen kationları və anionları əmələ gəlir.
Elektrolitik dissosiasiya- elektrolitin həlli və ya əriməsi zamanı onun ionlara parçalanması prosesi.
Elektrolitik dissosiasiyanın klassik nəzəriyyəsi 1887-ci ildə S.Arrenius və V.Ostvald tərəfindən yaradılmışdır. Arrhenius məhlulların fiziki nəzəriyyəsinə sadiq qaldı, elektrolitin su ilə qarşılıqlı təsirini nəzərə almadı və məhlullarda sərbəst ionların olduğuna inanırdı. Rus kimyaçıları İ. A. Kablukov və V. A. Kistyakovski elektrolitik dissosiasiyanı izah etmək üçün D. İ. Mendeleyevin məhlulların kimyəvi nəzəriyyəsindən istifadə etdilər və sübut etdilər ki, elektrolit həll edildikdə su ilə kimyəvi təsirə girir, nəticədə elektrolit ionlara parçalanır.
Elektrolitik dissosiasiyanın klassik nəzəriyyəsi α dissosiasiya dərəcəsi, yəni parçalanmış elektrolit molekullarının nisbəti ilə xarakterizə olunan məhlulun natamam dissosiasiyasının fərziyyəsinə əsaslanır. Dissosiasiya olunmayan molekullar və ionlar arasındakı dinamik tarazlıq kütlə hərəkəti qanunu ilə təsvir olunur.
İonlara parçalanan maddələrə elektrolitlər deyilir. Elektrolitlər ion və ya güclü kovalent bağı olan maddələrdir: turşular, əsaslar, duzlar. digər maddələr qeyri-elektrolitlərdir; bunlara qeyri-polyar və ya zəif qütblü kovalent bağları olan maddələr daxildir; məsələn, bir çox üzvi birləşmələr.
TED-in (Elektrolitik Dissosiasiya Nəzəriyyəsi) əsas müddəaları:
Molekullar müsbət və mənfi yüklü ionlara (sadə və mürəkkəb) parçalanır.
Elektrik cərəyanının təsiri altında kationlar (müsbət yüklü ionlar katoda (-) və anionlar (mənfi yüklü ionlar) anoda (+) doğru hərəkət edir)
Dissosiasiya dərəcəsi maddənin və həlledicinin təbiətindən, konsentrasiyadan, temperaturdan asılıdır.
Əgər dissosiasiya dərəcəsi maddənin təbiətindən asılıdırsa, o zaman müəyyən maddələr qrupları arasında fərqin olduğunu mühakimə etmək olar.
Böyük bir dissosiasiya dərəcəsi güclü elektrolitlərə (əksər əsaslar, duzlar, çoxlu turşular) xasdır. İonlara parçalanmanın geri dönən bir reaksiya olduğunu nəzərə almağa dəyər. Onu da qeyd etmək lazımdır ki, ikiqat və əsas duzların dissosiasiya nümunələri bu mövzuda təhlil edilməyəcək, onların dissosiasiyası “duzlar” mövzusunda təsvir edilmişdir.
Güclü elektrolitlərə nümunələr:
NaOH, K 2 SO 4, HClO 4
Dissosiasiya tənlikləri:
NaOH⇄Na + +OH -
K 2 SO 4 ⇄2K + + SO 4 2-
HClO 4 ⇄H + +ClO 4 -
Elektrolitlərin gücünün kəmiyyət xarakteristikası dissosiasiya dərəcəsidir (α) - dissosiasiya edilmiş elektrolitin molar konsentrasiyasının məhluldakı ümumi molyar konsentrasiyasına nisbəti.
Dissosiasiya dərəcəsi vahidin fraksiyaları və ya faizlə ifadə edilir. Dəyərlər diapazonu 0 ilə 100% arasındadır.
α = 0% qeyri-elektrolitlərə aiddir (dissosiasiya yoxdur)
0% <α < 100% относится к слабым электролитам (диссоциация неполная)
α = 100% güclü elektrolitlərə aiddir (tam dissosiasiya)
Dissosiasiya addımlarının sayını da xatırlamağa dəyər, məsələn:
H 2 SO 4 məhlulunun dissosiasiyası
H 2 SO 4 ⇄ H + + HSO 4 -
HSO 4 - ⇄H + +SO 4 2-
Hər bir dissosiasiya mərhələsinin özünəməxsus dissosiasiya dərəcəsi var.
Məsələn, CuCl 2, HgCl 2 duzlarının dissosiasiyası:
CuCl 2 ⇄Cu 2+ + 2Cl - dissosiasiya tamamilə gedir
Və civə xlorid vəziyyətində, dissosiasiya natamam və sonra tam deyil.
HgCl 2 ⇄HgCl + +Cl -
Kükürd turşusunun məhluluna qayıdaraq, seyreltilmiş turşunun hər iki mərhələsinin dissosiasiya dərəcəsinin konsentratdan qat-qat böyük olduğunu söyləməyə dəyər. Konsentratlı məhlulun dissosiasiyası zamanı çoxlu maddə molekulları və HSO 4 - hidroanionların yüksək konsentrasiyası olur.
Çoxəsaslı turşular və poliasid əsaslar üçün dissosiasiya bir neçə mərhələdə (əsaslıqdan asılı olaraq) gedir.
Güclü və zəif turşuları sadalayırıq və ion mübadiləsi tənliklərinə davam edirik:
Güclü turşular (HCl, HBr, HI, HClO 3 , HBrO 3 , HIO 3 , HClO 4 , H 2 SO 4 , H 2 SeO 4 , HNO 3 , HMnO 4 , H 2 Cr 2 O 7)
Zəif turşular (HF, H 2 S, H 2 Se, HClO, HBrO, H 2 SeO 3, HNO 2, H 3 PO 4, H 4 SiO 4, HCN, H 2 CO 3, CH 3 COOH)
Elektrolitlərin məhlullarında və ərimələrində kimyəvi reaksiyalar ionların iştirakı ilə gedir. Belə reaksiyalarda elementlərin oksidləşmə dərəcələri dəyişmir və reaksiyaların özü deyilir ion mübadiləsi reaksiyaları.
İon mübadiləsi reaksiyaları zəif həll olunan və ya praktiki olaraq həll olunmayan maddələr (çöküntülər), uçucu maddələr (qazlar şəklində ayrılır) və ya zəif elektrolitlər (məsələn, su) əmələ gələrsə (dönməz şəkildə) tamamlanmağa davam edəcəkdir.
İon mübadiləsi reaksiyaları adətən üç mərhələdə yazılır:
1. Molekulyar tənlik
2. Tam ion tənliyi
3. Azaldılmış ion tənliyi
Yazarkən, yağıntıları və qazları göstərməyinizə əmin olun, həmçinin həlledicilik cədvəlini rəhbər tutun.
Bütün reaktivlərin və məhsulların suda həll olunduğu reaksiyalar davam etmir.

Bir neçə nümunə:
Na 2 CO 3 + H 2 SO 4 → Na 2 SO 4 + CO 2 + H 2 O
2Na + +CO 3 2- +2H + +SO 4 2- →2Na + +SO 4 2- +CO 2 +H 2 O
CO 3 2- + 2H + → CO 2 + H 2 O
Qısaldılmış ion tənliyi tam ion tənliyinin hər iki tərəfindən eyni ionları kəsməklə əldə edilir.
İki duz arasında çöküntü əmələ gəlməsi ilə ion mübadiləsi reaksiyası baş verərsə, iki yüksək həll olunan reagent qəbul edilməlidir. Yəni, reaktivlərin həllolma qabiliyyəti məhsullardan birininkindən yüksək olarsa, ion mübadiləsi reaksiyası davam edəcəkdir.
Ba(NO 3) 2 + Na 2 SO 4 → BaSO 4 ↓ + 2NaNO 3
Bəzən ion mübadiləsi reaksiyalarını yazarkən tam ion tənliyini atlayır və dərhal qısaldılmış tənliyi yazır.
Ba 2+ +SO 4 2- → BaSO 4 ↓
Zəif həll olunan bir maddənin çöküntüsünü əldə etmək üçün həmişə onların konsentratlı məhlullarında yüksək həll olunan reagentləri seçmək lazımdır.
Məsələn:
2KF+FeCl 2 →FeF 2 ↓+2KCl
Fe 2+ +2F - → FeF 2 ↓
Məhsulların çökməsi üçün reagentlərin seçilməsi üçün bu qaydalar etibarlıdır yalnız duzlar üçün.
Yağıntı ilə reaksiyalara nümunələr:
1.Ba(OH) 2 + H 2 SO 4 → BaSO 4 ↓ + 2H 2 O
Ba 2+ +SO 4 2- → BaSO 4 ↓
2. AgNO 3 +KI→AgI↓+KNO 3
Ag + +I - →AgI↓
3.H 2 S+Pb(NO 3) 2 →PbS↓+2HNO 3
H 2 S+Pb 2+ →PbS↓+2H +
4. 2KOH + FeSO 4 → Fe(OH) 2 ↓ + K 2 SO 4
Fe 2+ +2OH - →Fe(OH) 2 ↓
Qazların təkamülü ilə reaksiyalara nümunələr:
1. CaCO 3 + 2HNO 3 → Ca (NO 3) 2 + CO 2 + H 2 O
CaCO 3 + 2H + → Ca 2+ + CO 2 + H 2 O
2. 2NH 4 Cl + Ca (OH) 2 → 2NH 3 + CaCl 2 + 2H 2 O
NH 4 + +OH - →NH 3 +H 2 O
3. ZnS+2HCl→H 2 S+ZnCl 2
ZnS+2H + →H 2 S+Zn 2+
Zəif elektrolitlərin əmələ gəlməsi ilə reaksiyalara nümunələr:
1.Mg (CH 3 COO) 2 + H 2 SO 4 → MgSO 4 + 2CH 3 COOH
CH 3 COO - + H + →CH 3 COOH
2. HI+NaOH→NaI+H 2 O
H + +OH - →H 2 O
Öyrənilən materialın imtahanlarda rast gəlinən konkret tapşırıqlara tətbiqini nəzərdən keçirin:
№1
.Maddələr arasında: NaCl, Na 2 S, Na 2 SO 4 - Cu (NO3) 2 məhlulu ilə reaksiyaya girir (-s)
1) yalnız Na 2 S
2) NaCl və Na 2 S
3) Na 2 S və Na 2 SO 4
4) NaCl və Na 2 SO 4
“Giriş” sözü “reaksiya gedir” deməkdir və yuxarıda qeyd edildiyi kimi, həll olmayan və ya az həll olunan maddə əmələ gəldikdə, qaz ayrıldıqda və ya zəif elektrolit (su) əmələ gəldikdə reaksiya davam edir.
Seçimləri bir-bir nəzərdən keçirək.
1) Cu(NO 3) 2 +Na 2 S→CuS↓+2NaNO 3 çöküntüsü əmələ gəldi.
2) NaCl + Cu (NO 3) 2 ↛CuCl 2 + 2NaNO 3
Yalnız Na 2 S ilə reaksiya çöküntü əmələ gəlməsi ilə davam edir
3) Na 2 S ilə də ilk iki nümunədə olduğu kimi çöküntü əmələ gəlməsi olacaq.
Na 2 SO 4 +Cu(NO 3) 2 ↛CuSO 4 +2NaNO 3
Bütün məhsullar yüksək həll olunan elektrolitlərdir, onlar qaz deyillər, buna görə də reaksiya getmir.
4) Na 2 SO 4 ilə reaksiya əvvəlki cavabda olduğu kimi getmir
NaCl+Cu(NO 3) 2 ↛CuCl 2 +2NaNO 3
Bütün məhsullar yüksək həll olunan elektrolitlərdir, onlar qaz deyillər, buna görə də reaksiya getmir.
Buna görə də uyğun 1 Mümkün cavab.
№2 . Qarşılıqlı təsir zamanı qaz sərbəst buraxılır
1) MgCl 2 və Ba (NO 3) 2
2) Na 2 CO 3 və CaCl 2
3) NH 4 C və NaOH
4) CuSO 4 və KOH
Bu cür tapşırıqlarda "qaz" sözü tam olaraq qazlar və uçucu birləşmələr deməkdir.
Tapşırıqlarda NH 3 H 2 O, H 2 CO 3 adətən belə birləşmələr kimi tapılır (normal reaksiya şəraitində CO 2 və H 2 O-ya parçalanır, karbon turşusunun tam formulunu yazmamaq adətdir, lakin dərhal onu qaza və suya boya) , H 2 S.
Yuxarıda göstərilən maddələrdən H 2 S əldə edə bilməyəcəyik, çünki bütün maddələrdə sulfid ionu yoxdur. Karbon dioksidi də ala bilmirik, çünki onu duzdan almaq üçün turşu əlavə etmək lazımdır və başqa bir duz natrium karbonatla birləşdirilir.
3 variantda qaz ala bilərik.
NH 4 Cl + NaOH → NH 3 + NaCl + H 2 O
Kəskin qoxu olan qaz buraxıldı.
Buna görə də uyğun 3 Mümkün cavab.
№3 .Xlorid turşusu ilə reaksiya verir
1) gümüş nitrat
2) barium nitrat
3) gümüş
4) silisium oksidi
Reagentlər arasında iki elektrolit var, reaksiyanın baş verməsi üçün bir çöküntünün fərqlənməsi lazımdır.
Hidroklor turşusu silisium oksidi ilə reaksiya verməyəcək və gümüş hidrogeni hidroklor turşusundan sıxışdırmayacaq.
Ba (NO 3) 2 + 2HCl → BaCl 2 + 2HNO 3 reaksiyası davam etməyəcək, çünki bütün məhsullar həll olunan elektrolitlərdir.
AgNO 3 +HCl→AgCl↓+NaNO 3
Gümüş nitratın ağ pendirli çöküntüsü düşəcək
Buna görə də uyğun 1
Mümkün cavab.
Aşağıdakı tapşırıq nümunəsi, ilk üçdən fərqli olaraq, KIM USE 2017-dən götürülmüşdür.
İlk üçlük KIM OGE 2017-dən götürülüb
Maddələrin düsturları və onların sulu məhlullarını ayırd edə biləcəyiniz bir reagent arasında yazışma qurun: hərflə göstərilən hər mövqe üçün nömrə ilə göstərilən müvafiq mövqeyi seçin.
MADDƏLƏRİN FORMULASI REAKENTİ
A) HNO 3 və H 2 O 1) CaCO 3
B) KCl və NaOH 2) KOH
B) NaCl və BaCl 2 3) HCl
D) AlCl 3 və MgCl 2 4) KNO 3
Bu tapşırığı yerinə yetirmək üçün əvvəlcə hər hərfin altında eyni məhlulda olan iki maddənin göstərildiyini başa düşməlisiniz və maddəni seçməlisiniz ki, onlardan ən azı biri verilən reagent maddə ilə keyfiyyətli reaksiyaya girsin. nömrə altında.
Azot turşusunun məhluluna kalsium karbonat əlavə edin, karbon qazı reaksiyanın əlaməti olacaq:
2HNO 3 + CaCO 3 → Ca (NO 3) 2 + CO 2 + H 2 O
Həmçinin, məntiqi olaraq, kalsium karbonat suda həll olunmur, bu o deməkdir ki, o, bütün digər məhlullarda da həll olunmayacaq, buna görə də qaz təkamülü ilə yanaşı, reaksiyanın əlamətlərinə kalsium karbonatın həlli də əlavə edilə bilər.
B hərfi altında olan məhlulu 3 rəqəmi altında xlorid turşusu ilə ayırd etmək olar, ancaq reaksiyadan sonra rəngini itirəcək bir indikatordan (fenolftalein) istifadə etməyə icazə verilsəydi, çünki qələvi zərərsizləşdiriləcəkdir. .
Buna görə də, OH - ion məhlulunda yalnız 5 məhlulunun (CuSO 4) köməyi ilə ayırd edə bilərik.
2NaOH+CuSO 4 →Cu(OH) 2 ↓+Na 2 SO 4
Mavi kristallar iki məhlulda əmələ gəlir.
B hərfi altında olan məhlulu 5 nömrəli reagentin köməyi ilə də ayırd etmək olar, çünki bariumla birləşən sulfat ionları dərhal ən güclü turşulardan belə artıq həll olunmayan ağ kristal çöküntüyə çökür.
BaCl 2 + CuSO 4 → CuCl 2 + BaSO 4 ↓
G hərfi altında olan məhlulu istənilən qələvi köməyi ilə ayırd etmək asandır, çünki reaksiya zamanı maqnezium və alüminium əsasları dərhal çökəcək. Qələvi 2 rəqəmi altında təmsil olunur
AlCl 3 +3KOH→Al(OH) 3 ↓+3KCl
MgCl 2 +2KOH→Mg(OH) 2 ↓+2KCl
Redaktor: Xarlamova Qalina Nikolaevna
Elektrolitik dissosiasiya - bu, qütb həlledici molekulların təsiri altında elektrolit molekullarının ionlara parçalanması prosesidir.
elektrolitlər- Bunlar ərimələri və ya sulu məhlulları elektrik cərəyanı keçirən maddələrdir. Bunlara turşuların, ərimələrin məhlulları və qələvilərin və duzların məhlulları daxildir. Qeyri-elektrolitlər elektrik cərəyanını keçirməyən maddələrdir. Bunlara bir çox üzvi maddələr daxildir.
Demək olar ki, tamamilə ionlara parçalanan elektrolitlər adlanır güclü; ionlara qismən dissosiasiya olunan elektrolitlər adlanır zəif. Dissosiasiyanın tamlığını kəmiyyətcə qiymətləndirmək üçün dissosiasiya dərəcəsi anlayışı təqdim olunur. Dissosiasiya dərəcəsi elektrolit ionlara parçalanan molekulların sayının məhluldakı molekulların ümumi sayına nisbəti adlanır.
Adətən dissosiasiya dərəcəsi ( α ) vahidin kəsrləri və ya% ilə ifadə edilir:
harada n elektrolitik dissosiasiyaya məruz qalan hissəciklərin sayıdır;
n 0 məhluldakı hissəciklərin ümumi sayıdır.
Güclü elektrolitlər - demək olar ki, bütün duzlar, həll olunan əsaslar ( NaOH, KOH, Ba(Oh) 2 s.), qeyri-üzvi turşular ( H 2 BELƏ Kİ 4 , HCl, HNO 3 , HBr, salam və s.) .
Zəif elektrolitlər- həll olunmayan əsaslar və NH 4 Oh, qeyri-üzvi turşular ( H 2 CO 3, , H 2 S, HNO 2, H 3 PO 4 və s.), üzvi turşular və su H 2 O.
Güclü elektrolitlər demək olar ki, tamamilə ionlara parçalanır (yəni, dissosiasiya prosesi geri dönməzdir) və bir mərhələdə:
HCl=H + +Cl – H 2 BELƏ Kİ 4 = 2H + + SO 4 2–
Zəif elektrolitlər qismən dissosiasiya olunur (yəni dissosiasiya prosesi geri çevrilir) və mərhələli şəkildə . Məsələn, çoxəsaslı turşular üçün hər mərhələdə bir hidrogen ionu ayrılır:
1.H 2 BELƏ Kİ 3 ⇄ H + + HSO 3 - 2. HSO 3 - ⇄ H + + SO 3 2-
Beləliklə, çoxəsaslı turşuların mərhələlərinin sayı turşunun əsaslılığı (hidrogen ionlarının sayı), politurşu əsaslarının mərhələlərinin sayı isə əsasın turşuluğu (və ya hidroksil qruplarının sayı) ilə müəyyən edilir. : NH 4
Oh
⇄
NH 4
+
+
Oh –
.
Elektrolitik dissosiasiya prosesi sistemdə tarazlıq sabiti ilə xarakterizə olunan kimyəvi tarazlıq vəziyyətinin qurulması ilə başa çatır: 
Elektrolitik dissosiasiya prosesinin tarazlıq sabiti dissosiasiya sabiti adlanır - TO D. Dissosiasiya sabiti elektrolitin təbiətindən, həlledicinin təbiətindən, temperaturdan asılıdır, lakin elektrolitin konsentrasiyasından asılı deyil.
Arasında TO D və α Kəmiyyət əlaqəsi var
 (13)
(13)
Münasibət (13) Ostwald qatılma qanunu adlanır: zəif elektrolitin dissosiasiya dərəcəsi məhlulun seyreltilməsi ilə artır.
Zəif elektrolitlər üçün, α olduqda 1, TO D = α 2 İLƏ.
Su zəif elektrolitdir, buna görə də geri dönən şəkildə dissosiasiya olunur:
H 2 O ⇄ H + + Oh – ∆ H\u003d + 56,5 kJ / mol
Su dissosiasiya sabiti: 
Suyun dissosiasiya dərəcəsi çox kiçikdir (çox zəif elektrolitdir). Su böyük miqdarda olduğundan, onun konsentrasiyası sabit bir dəyər hesab edilə bilər və belədir  , sonra
, sonra
TO D [ H 2 O] = [ H + ]∙[ Oh - ] = 55,6∙1,8∙10 -16 = 10 -14
[ H + ]∙[ Oh - ] = 10 -14 = K W suyun ion məhsuludur
Suda hidrogen kationlarının və hidroksid ionlarının konsentrasiyası bərabər olduğundan: [
H +
]
= [
Oh -
]
=
 .
.
Digər maddələrin (turşuların, əsasların, duzların) suda həll edilməsi ionların konsentrasiyasını dəyişir H + və ya O – , və onların məhsulu həmişə sabit qalır və T \u003d 25 0 C-də 10 -14-ə bərabərdir. İonların konsentrasiyası H + məhlulun turşuluğunun və ya qələviliyinin ölçüsü kimi xidmət edə bilər. Adətən bu məqsədlə pH göstəricisi istifadə olunur: pH = - lg[ H + ]. Bu cür, pH dəyəriəks işarə ilə alınan hidrogen ionlarının konsentrasiyasının onluq loqarifmidir.
Hidrogen ionlarının konsentrasiyasından asılı olaraq üç mühit fərqlənir.
V neytral mühit [ H + ] = [ Oh - ]= 10 -7 mol/l, pH= –lg 10 -7 = 7 . Bu mühit həm təmiz su, həm də neytral məhlullar üçün xarakterikdir. V turş həllər [ H + ] > 10 -7 mol/l, pH< 7 . Turşu mühitlərdə pH daxilində dəyişir 0 < рН < 7 . V qələvi mühitlər [ H + ] < [ОН – ] və [ H + ] < 10 -7 mol/l, deməli, pH > 7. pH dəyişməsinin hədləri: 7 < рН < 14 .
İon mübadiləsi reaksiyaları (RIO)- bunlar elektrolitlərin sulu məhlullarında baş verən ionlar arasındakı reaksiyalardır. Mübadilə reaksiyalarının fərqli xüsusiyyəti ondan ibarətdir ki, reaktivləri təşkil edən elementlər oksidləşmə vəziyyətini dəyişmir. İon mübadiləsi reaksiyaları geri dönməz reaksiyalardır və davam edir təmin edilmişdir: 1) zəif həll olunan maddənin əmələ gəlməsi, 2) qaz halında bir maddənin ayrılması, 3) zəif elektrolitin əmələ gəlməsi.
RIO baş verdikdə, əks yüklü ionlar bağlanır və reaksiya sferasından çıxarılır. İon mübadiləsi reaksiyalarının mahiyyəti, molekulyar reaksiyalardan fərqli olaraq, reaksiyanın həqiqi iştirakçılarını göstərən ion tənliklərindən istifadə etməklə ifadə edilir. İon tənlikləri tərtib edərkən, bir az dissosiasiya edən, bir az həll olunan (çökmə) və qaz halında olan maddələrin molekulyar formada yazıldığını rəhbər tutmaq lazımdır. Güclü həll olunan elektrolitlər ion şəklində yazılır. Buna görə də ion tənlikləri yazarkən duzların və əsasların suda həll olma qabiliyyəti cədvəlindən istifadə etmək lazımdır.
Hidroliz- bu, duz ionlarının su molekulları ilə qarşılıqlı təsiri prosesidir və aşağı dissosiasiya edən birləşmələrin əmələ gəlməsinə səbəb olur; ion mübadiləsi reaksiyalarının xüsusi halıdır. Hidroliz əmələ gələn duzlara məruz qalır:
zəif turşu və güclü əsas ( NaCH 3 COO, Na 2 CO 3 , Na 2 S, );
zəif əsas və güclü turşu NH 4 Cl, FeCl 3 , AlCl 3 ,);
zəif əsas və zəif turşu NH 4 CN, NH 4 CH 3 COO).
Güclü turşu və güclü əsasdan əmələ gələn duzlar hidrolizdən keçmir: Na 2 BELƏ Kİ 4 , BaCl 2 , NaCl, NaJ və s.
Duz hidrolizi ion konsentrasiyalarını artırır H + və ya O – . Bu, suyun ion tarazlığının dəyişməsinə gətirib çıxarır və duzun təbiətindən asılı olaraq məhlula turşu və ya qələvi mühit verir (məsələlərin həlli nümunələrinə bax).
Məqsəd. Elektrolit məhlullarında baş verən reaksiyaların molekulyar və ion tənliklərini tərtib etmək bacarıqlarına yiyələnmək. İon reaksiyalarının istiqamətini təyin etməyi öyrənin.
Bəzi maddələr suda (və ya digər qütb həlledicilərdə) həll edildikdə, həlledici molekulların təsiri altında bu maddənin molekulları ionlara parçalanır. Bu proses nəticəsində məhlulda təkcə həlledici və məhlulun molekulları deyil, həm də əmələ gələn ionlar olur. Suda və ya digər qütb həlledicilərdə həll olunduqda ionlara parçalanan maddələrin məhlullarına elektrolitlər deyilir.
Qütb həlledici molekulların təsiri altında həll olunan (elektrolit) molekullarının ionlara parçalanması prosesi elektrolitik dissosiasiya adlanır.
Elektrolit məhlulları ion elektrik keçiriciliyinə malikdir (ionlar elektrik yüklərinin ötürülməsində iştirak edir) və ikinci növ keçiricilərdir.
Məhlulun ionlara parçalanması prosesinin kəmiyyət xarakteristikası elektrolitik dissosiasiya dərəcəsidir - α. Dissosiasiya dərəcəsi məhlulda ionlara parçalanan məhlul molekullarının sayının (n) həll olunmuş molekulların ümumi sayına (N) nisbətidir:
Elektrolitik dissosiasiya dərəcəsi empirik olaraq müəyyən edilir və ya vahidin fraksiyaları, ya da faizlə ifadə edilir. Elektrolitin dissosiasiya dərəcəsi elektrolitin təbiətindən, konsentrasiyasından və temperaturundan asılıdır.
Molar konsentrasiyası olan məhlulda elektrolitlərin dissosiasiya dərəcəsinə görə
0,1 mol / l (0,1 n.) bərabər ekvivalent konsentrasiyası, şərti həllər
üç qrupa bölünür: güclü, zəif və orta elektrolitlər. Əgər daxil
0,1 N elektrolit məhlulu α > 0,3 (30 \%) elektrolit güclü hesab olunur, α ≤ 0,03 (3 \%) - zəif elektrolit. Dissosiasiya dərəcəsinin aralıq qiymətləri olan elektrolitlər orta hesab olunur.
Güclü elektrolitlərə, əgər həlledici sudursa, nisbətən
– turşular: НNO3, H2SO4, НCNS, НCl, НClO3, HClO4, HBr, HBrО3, HBrО4, НI, НIO3 HMnO4, H2SeO4, HReO4, HTcO4; eləcə də dissosiasiyanın birinci mərhələsində, yəni birinci H+ ionu ayrıldıqda güclü olan H2CrO4, H4P2O7, H2S2O6 turşuları;
– əsaslar: qələvi hidroksidləri (Li, Na, K, Rb, Cs, Fr) və qələvi yer metalları (Ca, Sr, Ba, Ra): LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2 , Ba(OH)2, Sr(OH)2; Ra(OH)2; həmçinin TlOH;
duzların çoxu. İstisna: Fe(SCN)3, Mg(CN)2, HgCl2, Hg(CN)2.
Zəif elektrolitlərə aşağıdakılar daxildir:
– turşular: H2CO3, HClO, H2S, H3BO3, HCN, H2SO3, H2SiO3, CH3COOH, HCOOH, H2C2O4 və s. (Əlavə, Cədvəl 2);
– əsaslar (р- və d- elementləri): Be(OH)2, Mg(OH)2, Fe(OH)2, Zn(OH)2; ammonium hidroksid NH4OH, həmçinin üzvi əsaslar – aminlər (CH3NH2) və amfolitlər (H3N+CH2COOˉ).
Su çox zəif elektrolitdir (H2O) α = 2 10-9, yəni.
su molekulları da molekulların bir-biri ilə qarşılıqlı təsiri nəticəsində ionlara parçalana bilir.
Güclü elektrolitlər suda həll edildikdə tamamilə ionlara parçalanan, yəni demək olar ki, tamamilə parçalanan maddələrdir. Su molekullarının təsiri altında elektrolit molekulunda olan ionlar arasındakı əlaqəni pozduqdan sonra əmələ gələn ionlar su molekulları ilə əhatə olunur və buna görə də məhlulda hidratlanmış vəziyyətdə olurlar. İonların hidratlanmasını nəzərə alaraq, elektrolitik dissosiasiya tənliyini aşağıdakı kimi yazmaq olar:
|
|
Güclü elektrolit üçün dissosiasiya tənliyi sadələşdirilmiş şəkildə yazılır:
Misal üçün:
NaCl → Na+ + Clˉ;
HNO3 → H+ + NO3ˉ;
Ba(OH)2 → Ba2+ + 2OHˉ
Zəif elektrolitlərə suda həll olunduqda qismən ionlara ayrılan maddələr daxildir. Məhlulda konsentrasiyası az olan ionlarla faktiki olaraq mövcud olan dissosiasiya olunmamış molekullar arasında tarazlıq yaranır:
CH3COOH ⇄ CH3COOˉ + H+; H2O ⇄ H+ + OHˉ.
Bu qeyd məhlulda eyni vaxtda iki prosesin baş verdiyini bildirir.
proses: molekulların ionlara parçalanması və ionlardan molekulların əmələ gəlməsi. Zəif elektrolitlərin məhlullarında tarazlıq başlanğıc məhsullara doğru dəyişir, buna görə də məhlulda zəif elektrolitlər əsasən molekullar şəklində mövcuddur.
Elektrolit məhlullarının kimyəvi xassələri məhlulda mövcud olan ionların və molekulların xüsusiyyətlərindən asılıdır. Elektrolit məhlullarında ionlar və molekullar arasında reaksiyaların istiqaməti zəif həll olunan maddələrin və ya zəif elektrolitlərin əmələ gəlmə ehtimalı ilə müəyyən edilir. Əgər reaksiya zəif həll olunan maddənin və ya zəif elektrolitin əmələ gəlməsi ilə nəticələnmirsə, belə bir reaksiya davam edə bilməz. Məsələn, natrium nitrat və kalium xlorid məhlulları töküldükdə reaksiya getmir, çünki mübadilə reaksiyası ilə məhluldakı ionlardan hər hansı zəif həll olunan maddə və ya zəif elektrolit əmələ gələ bilməz. Bu duzlar güclü elektrolitlərdir və suda çox həll olunur, buna görə də məhlulun tərkibində olacaqdır
ion qarışığı:
Na+ + NO3ˉ + K+ + Clˉ,
ilkin maddələr ondan ibarət idi. Ona görə də bu halda mübadilə reaksiyasının molekulyar tənliyini yazmaq mümkün deyil
NaNO3 + KCl ≠ KNO3 + NaCl.
Məhlulda baş verən reaksiya aşağıdakı kimi təqdim edilə bilər:
Molekulyar reaksiya tənliyi;
İon-molekulyar tənlik (tam və ya azaldılmış).
Yalnız dissosiasiya olunmamış maddələrin düsturlarını ehtiva edən reaksiya tənliyinə molekulyar tənlik deyilir. Tənliyin molekulyar forması reaksiyada hansı maddələrin və hansı miqdarda iştirak etdiyini göstərir. Bu reaksiya ilə bağlı lazımi hesablamaları aparmağa imkan verir. Tərkibində dissosiasiya olunmamış zəif elektrolitlərin və güclü elektrolitlərin ionlarının düsturlarını ehtiva edən tənliyə tam ion və ya ion-molekulyar reaksiya tənliyi deyilir.
İon-molekulyar reaksiya tənliyinin sol və sağ hissələrində eyni məhsulları azaltmaqla qısaldılmış və ya qısa ion reaksiya tənliyi əldə edirik. Reaksiyanın sol və sağ hissələrində eyni maddələr (ionlar və ya molekullar) olmayan ion tənliyinə azaldılmış və ya qısa ion reaksiya tənliyi deyilir. Bu tənlik baş verən reaksiyanın mahiyyətini əks etdirir.
İon reaksiya tənliklərini yazarkən yadda saxlamalısınız:
1) güclü elektrolitlər ayrıca yazılmalıdır
onları əmələ gətirən ionlar;
2) zəif elektrolitlər və zəif həll olunan maddələr yazılmalıdır
molekullar şəklində əmələ gəlir.
Nümunə olaraq sodanın turşu ilə qarşılıqlı təsirini nəzərdən keçirək. Molekulyar reaksiya tənliyində ilkin maddələr və reaksiya məhsulları molekullar şəklində yazılır:
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O.
Nəzərə alsaq ki, sulu məhlulda elektrolitik molekulların
ionların ionlara parçalanması, bu reaksiyanın tam ion tənliyi formasına malikdir
CO2–İon tənliyində zəif elektrolitlər, qazlar və zəif həll olunan maddələr molekullar kimi yazılır. Maddənin düsturunda ↓ işarəsi bu maddənin formada reaksiya sferasından çıxarıldığını bildirir
çöküntü, işarəsi isə maddənin reaksiya sferasından qaz halında çıxarıldığını bildirir.
Molekulları tamamilə ionlara (güclü elektrolitlərə) ayrılan maddələr ion kimi yazılır. Tənliyin sol tərəfindəki elektrik yüklərinin cəmi sağ tərəfdəki elektrik yüklərinin cəminə bərabər olmalıdır.
İon tənliklərini yazarkən turşuların, əsasların və duzların suda həllolma cədvəlini rəhbər tutmaq lazımdır, yəni reagentlərin və məhsulların həllolma qabiliyyətini yoxlamaq, bunu tənliklərdə qeyd etmək, həmçinin dissosiasiya sabitləri cədvəlini aparmaq lazımdır. zəif elektrolitlərin (Əlavə, Cədvəl 1 və 2). Bəzi ion-molekulyar tənliklərin yazılması nümunələrini nəzərdən keçirək.
Nümunə 1. Çətin və az həll olunan birləşmələrin (çöküntü) əmələ gəlməsi.
a) Barium sulfatın əmələ gəlməsi
Molekulyar reaksiya tənliyi:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl.
Tam ion (ion-molekulyar) reaksiya tənliyi:
Ba2+ + 2Clˉ + 2Na+ + SO4 ˉ = BaSO4↓ + 2Na
CO2–CO2 + H2O (qısaldılmış ion tənliyi).
Misal 3. Zəif elektrolitin əmələ gəlməsi.
2Na+ + 2OH– +2H+ + SO 2–(tam ion tənliyi)
2OH– + 2H+ = 2H2O (qısaldılmış ion tənliyi).
Güclü turşunun güclü əsasla neytrallaşdırılması reaksiyası hidrogen ionlarının hidroksid ionları ilə qarşılıqlı təsirinə endirilir;
b) zəif turşu:
2NaNO2 + H2SO4 = 2HNO2 + Na2SO4 (molekulyar tənlik)
NH+(tam ion tənliyi)
NH4OH (qısaldılmış ion tənliyi).
Güclü əsaslar zəif əsasları duzlarından sıxışdırır.
Misal 4. Başlanğıc birləşmələr və reaksiya məhsulları arasında zəif elektrolit və ya zəif həll olunan maddə olduqda, tənlik -
Xia balans işarəsi "⇄". Reaksiyadakı tarazlıq daha zəif elektrolitə və ya zəif həll olunan maddəyə doğru sürüşür.
işarəsi (↷)..
a) CH3COOH + NaOH ⇄ CH3COONa + H2O
CH3COOH + OHˉ ⇄ CH3COOˉ + H2O (↷).
Reaksiya nəticəsində daha zəif elektrolit - su əmələ gəlir. bərabər-
bu birbaşa reaksiya istiqamətində sürüşür.
b) CaSO4↓ + Na2CO3 ⇄ CaCO3↓ + Na2SO4;
|
|
⇄ CaCO3↓ + 2 Na+
Reaksiya nəticəsində daha az həll olunan duz əmələ gəlir - kalsium karbonat
tion. Tarazlıq birbaşa reaksiya istiqamətində dəyişir.
Nümunə 5. Üç mümkün molekulyar reaksiya tənliyini yazın,
azaldılmış ion tənliyinə uyğundur: CH3COO– + H+ = CH3COOH.
Həll. Sərbəst ionlar CH3COO– və H+ ion tənliyinin sol tərəfində göstərilmişdir. Bu ionlar istənilən həll olunan güclü elektrolitlərin dissosiasiyası zamanı əmələ gəlir. CH3COO– ionları, məsələn, KCH3COO, NaCH3COO, Mg (CH3COO)2 duzlarının dissosiasiyası zamanı əmələ gələ bilər; yod donorları
yeni H+ istənilən güclü turşu ola bilər. Molekulyar reaksiya tənlikləri,
bu molekulyar-ion tənliyinə uyğun gələn ola bilər:
1. KCH3COO + HCl = CH3COOH + KCl;
2. NaCH3COO + HNO3 = CH3COOH + NaNO3;
3. Mg(CH3COO)2 + H2SO4 = 2 CH3COOH + MgSO4.
Təhlükəsizlik
1. Turşuların və qələvilərin məhlulları ilə işləyərkən xüsusi diqqətli olun, onların dəri və paltarla təmas etməsinə icazə verməyin.
2. Təcrübə zamanı zəhərli qazlı məhsul buraxılarsa, o zaman eksperimenti ventilyasiya işləyən buxar qapağında aparmağınızdan əmin olun.
3. Zəhərli duzlar və onların məhlulları (barium, xrom, mis və s. duzları) ilə işləyərkən diqqətli olun.
- İrrasional ifadələr (köklü ifadələr) və onların çevrilməsi
- Saltykov-Şchedrin M-in "Bir adamın iki generalı necə yedizdirdiyi haqqında nağıl" əsərinin təkrarlanması
- Vasili Ermolaevich Bugor Arktika naviqatoru və Sibirin qabaqcıllarından biri idi.
- Arena izomerləri. Arene molekullarının quruluşu. σ-kompleksinin sabitləşməsi. Əsasın köməyi ilə σ-kompleksdən protonun ayrılması yolu ilə həyata keçirilir. Bu halda, C - H qırılan kovalent rabitənin iki elektronu hesabına qapalı π-sistem bərpa olunur.
- Borscht 8 səviyyəsinə hansı avadanlıq qoymaq lazımdır
- M56 Scorpion — VII dərəcəli Amerika tank məhv edən
- Sink və onun birləşmələrinin kimyəvi xassələri
- Canlı sistemlərin həyat təşkili səviyyələri
- Odessada siyənəkdən forşmakı yəhudi üsulu ilə və yeni üsulla necə bişirmək olar klassik yəhudi resepti siyənək balığından Forşmak
- Amerika balqabaq pastası
- Çiyələk ilə bişmədən kəsmikli tort
- "Qar altında göbələk" salatı "Qar altında göbələk" salatı - fotoşəkil ilə addım-addım resept
- Donuz yağı ilə şokoladlı çərəzlər
- Qış üçün yavaş sobada evdə hazırlanmış balqabaq kürüsü: sadə və çox dadlı balqabaq kürüsü yavaş ocaqda sürətli resept
- Mayalı xəmirdən ətli piroqlar Piroqlar üçün ət dolması necə bişirilir
- Balqabaqlı pancake Balqabaqlı pancake necə hazırlanır
- Fırında rütubət, temperatur
- Yüngül buzlanma ilə mükəmməl zəncəfil reseptləri üçün zəncəfil çörək reseptləri
- Balqabaq kürüsünü ənənəvi şəkildə və yavaş ocaqda necə bişirmək olar?
- Tarixə zəng etmək üçün sehrlər Bir tarixə zəng etmək üçün sehrlər