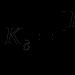Izomery areny. Budowa cząsteczek arenowych. Stabilizacja kompleksu σ. Odbywa się to przez oddzielenie protonu od kompleksu σ za pomocą zasady. W tym przypadku, dzięki dwóm elektronom zerwania wiązania kowalencyjnego C - H, przywracany jest zamknięty układ π
Aromatyczne węglowodory- związki węgla i wodoru, w cząsteczce których znajduje się pierścień benzenowy. Najważniejszymi przedstawicielami węglowodorów aromatycznych są benzen i jego homologi - produkty podstawienia reszt węglowodorowych jednego lub więcej atomów wodoru w cząsteczce benzenu.
Struktura cząsteczki benzenu
Pierwszy związek aromatyczny, benzen, odkrył w 1825 roku M. Faraday. Ustalono jego wzór cząsteczkowy - C 6 H 6. Jeśli porównamy jego skład ze składem nasyconego węglowodoru zawierającego taką samą liczbę atomów węgla, heksanu (C 6 H 14), widzimy, że benzen zawiera o osiem atomów wodoru mniej. Jak wiadomo, pojawienie się wielu wiązań i cykli prowadzi do zmniejszenia liczby atomów wodoru w cząsteczce węglowodoru. W 1865 r. F. Kekule zaproponował jego wzór strukturalny jako cykloheksantrien - 1, 3, 5.

Więc cząsteczka odpowiadająca Formuła Kekule, zawiera wiązania podwójne, dlatego benzen musi mieć charakter nienasycony, tj. łatwo wejść w reakcje addycyjne: uwodornienie, bromowanie, uwodnienie itp.
Jednak dane z licznych eksperymentów wykazały, że benzen wchodzi w reakcje addycji tylko w trudnych warunkach (w wysokich temperaturach i świetle) i jest odporny na utlenianie. Najbardziej charakterystyczne są dla niego reakcje substytucji, dlatego benzen ma charakter bliższy węglowodorom marginalnym.
Próbując wyjaśnić te niespójności, wielu naukowców zaproponowało różne opcje budowy benzenu. Struktura cząsteczki benzenu została ostatecznie potwierdzona przez reakcję jej tworzenia z acetylenu. W rzeczywistości wiązania węgiel-węgiel w benzenie są równoważne, a ich właściwości nie są podobne do wiązań pojedynczych ani podwójnych.
Obecnie benzen jest oznaczony wzorem Kekule lub sześciokątem, w którym przedstawiono okrąg.
![]()
Jaka jest więc osobliwość struktury benzenu? Na podstawie danych i obliczeń naukowców stwierdzono, że w stanie znajduje się wszystkie sześć atomów węgla sp 2 hybrydyzacji i leżą na tej samej płaszczyźnie. niezhybrydyzowany P-orbitale atomów węgla tworzące wiązania podwójne (wzór Kekule) są prostopadłe do płaszczyzny pierścienia i równoległe do siebie.
Zachodzą one na siebie, tworząc jeden układ π. Zatem układ naprzemiennych wiązań podwójnych przedstawiony we wzorze Kekule jest cyklicznym układem sprzężonych, nakładających się wiązań α. System ten składa się z dwóch toroidalnych (podobnych do pączków) obszarów gęstości elektronowej, leżących po obu stronach pierścienia benzenowego. Dlatego bardziej logiczne jest przedstawianie benzenu jako regularnego sześciokąta z kołem pośrodku (układ π) niż jako cykloheksatrien-1,3,5. 
Amerykański naukowiec L. Pauling zaproponował przedstawienie benzenu jako dwóch struktur granicznych, które różnią się rozkładem gęstości elektronowej i nieustannie przekształcają się w siebie, to znaczy, aby uznać go za związek pośredni, „uśrednienie” dwóch struktur.
Zmierzone długości wiązań potwierdzają te założenia. Stwierdzono, że wszystkie wiązania C-C w benzenie mają tę samą długość (0,139 nm). Są nieco krótsze niż pojedyncze wiązania C-C (0,154 nm) i dłuższe niż podwójne (0,132 nm).
Istnieją również związki, których cząsteczki zawierają kilka struktur cyklicznych.

Izomeria i nazewnictwo
Homologi benzenu charakteryzują się izomeria pozycyjna kilku podstawników. Najprostszy homolog benzenu, toluen (metylobenzen), nie ma takich izomerów; następujący homolog jest przedstawiony jako cztery izomery:

Podstawą nazwy węglowodoru aromatycznego z małymi podstawnikami jest słowo benzen. Atomy w pierścieniu aromatycznym są ponumerowane od najwyższego do najmłodszego podstawnika:

Zgodnie ze starą nomenklaturą pozycje 2 i 6 nazywają się pozycje orto, 4 - para- oraz 3 i 5 - metapozycje.
Właściwości fizyczne
Benzen i jego najprostsze homologi w normalnych warunkach są bardzo toksycznymi cieczami o charakterystycznym nieprzyjemnym zapachu. Są słabo rozpuszczalne w wodzie, ale dobrze - w rozpuszczalnikach organicznych.
Właściwości chemiczne benzenu
Reakcje podstawienia. Węglowodory aromatyczne wchodzą w reakcje substytucji.
1. Bromowanie. Podczas reakcji z bromem w obecności katalizatora, bromku żelaza (ΙΙΙ), jeden z atomów wodoru w pierścieniu benzenowym można zastąpić atomem bromu:

2. Azotowanie benzenu i jego homologów. Gdy węglowodór aromatyczny oddziałuje z kwasem azotowym w obecności kwasu siarkowego (mieszanina kwasu siarkowego i azotowego nazywana jest mieszaniną nitrującą), atom wodoru zostaje zastąpiony grupą nitrową -NO 2:

Redukując nitrobenzen powstający w tej reakcji otrzymuje się anilinę - substancję, która służy do otrzymywania barwników anilinowych:

Ta reakcja została nazwana na cześć rosyjskiego chemika Zinina.
Reakcje dodawania. Związki aromatyczne mogą również wejść w reakcje addycji do pierścienia benzenowego. W tym przypadku powstaje cykloheksan lub jego pochodne.
1. uwodornienie. Katalityczne uwodornienie benzenu przebiega w wyższej temperaturze niż uwodornienie alkenów:
![]()
2. Chlorowanie. Reakcja przebiega przy oświetleniu światłem ultrafioletowym i jest wolnym rodnikiem:

Homologi benzenu
Skład ich cząsteczek odpowiada wzorowi C n H 2 n-6. Najbliższe homologi benzenu to:
Wszystkie homologi benzenu następujące po toluenie mają izomery. Izomerię można powiązać zarówno z liczbą i strukturą podstawnika (1, 2), jak iz pozycją podstawnika w pierścieniu benzenowym (2, 3, 4). Związki o wzorze ogólnym C 8 H 10:

Zgodnie ze starą nomenklaturą używaną do wskazania względnej pozycji dwóch identycznych lub różnych podstawników w pierścieniu benzenowym stosuje się przedrostki orto- (w skrócie o-) - podstawniki znajdują się przy sąsiednich atomach węgla, meta-(m-) - przez jeden atom węgla i para— (P-) - zastępują się nawzajem.
Pierwszymi przedstawicielami homologicznej serii benzenu są ciecze o specyficznym zapachu. Są lżejsze od wody. Są dobrymi rozpuszczalnikami.
Reagują homologi benzenu substytucja ( bromowanie, nitrowanie). Toluen jest utleniany nadmanganianem po podgrzaniu:

Homologi benzenowe są stosowane jako rozpuszczalniki do produkcji barwników, środków ochrony roślin, tworzyw sztucznych i leków.



















Benzen
Najprostszym przedstawicielem arenów jest benzen. Przyjrzyjmy się bliżej jego właściwościom.
Właściwości fizyczne
Benzen jest przezroczystą, bezbarwną, lotną cieczą o charakterystycznym zapachu (to właśnie z powodu silnego zapachu związki aromatyczne otrzymały swoją nazwę). Temperatura topnienia 5,5°C, temperatura wrzenia - 80°C. Nie miesza się z wodą, ale miesza się z większością rozpuszczalników organicznych. Jest rozpuszczalnikiem niepolarnych substancji organicznych. Spala się dymiącym płomieniem (niepełne spalanie) tworząc oprócz dwutlenku węgla i wody znaczną ilość sadzy. Wdychany jest trujący zarówno w postaci cieczy, jak i oparów.
Zdobywanie benzenu
1. W przemyśle benzen otrzymuje się przez reforming oleju, który polega zasadniczo na odwodornieniu alkanów olejowych z utworzeniem cyklicznego szkieletu. W swojej „czystej” postaci główną reakcją reformingu jest odwodornienie heksanu:
Ponadto benzen jest jednym z lotnych produktów koksowniczych. Koksowanie to podgrzewanie węgla do 1000°C bez powietrza. Produkuje to również wiele innych cennych odczynników do syntezy organicznej oraz koksu wykorzystywanych w metalurgii. Benzen można również otrzymać przez trimeryzację acetylenu nad węglem aktywnym w 100°C.
2. Oczywiście benzen nie jest pozyskiwany w laboratorium, ale teoretycznie istnieją metody jego syntezy (są one wykorzystywane do otrzymywania jego pochodnych). Na poniższym wykresie przedstawiono zarówno metody przemysłowe, jak i laboratoryjne.
Schemat metody otrzymywania benzenu
metody przemysłowe.

Właściwości chemiczne benzenu
O właściwościach chemicznych benzenu decyduje oczywiście jego układ p. Podobnie jak w przypadku alkenów, może zostać zaatakowany przez cząstkę elektrofilową. Jednak w przypadku związków aromatycznych wynik takiego ataku będzie zupełnie inny. Wysoka stabilność p-układu powoduje, że pod koniec reakcji jest on zwykle redukowany, a wynikiem reakcji nie jest dodawanie (co zniszczyłoby
układ p) i podstawienie elektrofilowe. Przyjrzyjmy się bliżej jego mechanizmowi.
W pierwszym etapie atak cząsteczki AB zawierającej centrum elektrofilowe A prowadzi do powstania niezwykle niestabilnego kompleksu p (etap 1). Jednocześnie nie został zakłócony układ aromatyczny. Następnie pomiędzy jednym z atomów pierścienia a cząstką A powstaje wiązanie kowalencyjne (etap 2). W tym przypadku po pierwsze pęka wiązanie A-B, a po drugie p-system zostaje zniszczony. Powstała niestabilna, dodatnio naładowana cząsteczka nazywana jest s-kompleksem. Jak już wspomniano, odbudowa układu p jest bardzo korzystna energetycznie, a to prowadzi do zerwania wiązania C-A (a następnie cząsteczka powraca do stanu pierwotnego) lub wiązania C-H (etap 3). W tym ostatnim przypadku reakcja kończy się i otrzymuje się produkt podstawienia wodoru za A.

Większość reakcji związków aromatycznych ma właśnie taki mechanizm (podstawienie elektrofilowe, w skrócie S E). Rozważmy niektóre z nich.
1. Halogenacja. Występuje tylko w obecności katalizatorów – kwasów Lewisa (patrz „Teoria Lewisa”). Zadaniem katalizatora jest polaryzacja cząsteczki halogenu w celu utworzenia dobrego centrum elektrofilowego:
| AlCl 3 +Cl 2 "Cl + [AlCl 4] - Powstała cząstka ma elektrofilowy atom chloru i
reakcja ma miejsce:

DO Nitrowanie. Przeprowadza się go mieszaniną kwasu azotowego i siarkowego (mieszanina azotująca). W mieszaninie nitrującej zachodzi następująca reakcja:
HNO 3 + H 2 SO 4 "NO + 2 + H 2 O
W powstałym wodorosiarczanie nitroniowym znajduje się potężne centrum elektrofilowe - jon nitroniowy NO + 2. W związku z tym zachodzi reakcja, której ogólne równanie to:
![]()
3. Sulfonacja. W stężonym kwasie siarkowym istnieje równowaga:
2H 2 SO 4 "SO 3 H + - + H 2 O
W cząsteczce po prawej stronie równowagi znajduje się silny elektrofil SO 3 H + , który reaguje z benzenem. Wynikowa reakcja:
![]()
Alkilacja według Friedel-Craftsa. Gdy benzen reaguje z chlorkami alkilu lub alkenami w obecności kwasów Lewisa (zwykle halogenków glinu), otrzymuje się benzeny podstawione alkilem. W przypadku halogenków alkilowych pierwszy etap procesu:
RCl + AlCl 3 "R + [AlCl 4] - W drugim etapie elektrofilowa cząstka R + atakuje układ p:
![]()
W przypadku alkenów kwas Lewisa polaryzuje podwójne wiązanie alkenu i ponownie na węglu tworzy się centrum elektrofilowe:

Reakcje nieelektrofilne obejmują:
1. uwodornienie benzenu. Ta reakcja przebiega z destrukcją układu p i wymaga surowych warunków (wysokie ciśnienie, temperatura, katalizator - metale platynowe):
![]()
2. chlorowanie rodnikowe. W przypadku braku kwasów Lewisa i silnego promieniowania ultrafioletowego benzen może reagować z chlorem w mechanizmie rodnikowym. W tym przypadku system p ulega zniszczeniu i powstaje produkt dodawania chloru - substancja stała heksachloran, która wcześniej była używana jako insektycyd:

Homologi benzenu
Nazewnictwo i izomeria aren
Wszystkie areny można warunkowo podzielić na dwa rzędy. Pierwszy rząd - pochodne benzenu (toluen, difenyl): drugi rząd - skondensowane (wielopierścieniowe) areny (naftalen, antracen).

Rozważmy homologiczną serię benzenu, związki z tej serii mają ogólny wzór C n H 2 n. 6. Izomeria strukturalna w szeregu homologicznym benzenu wynika z wzajemnego ułożenia podstawników w jądrze. Monopodstawione pochodne benzenu nie mają izomerów pozycji, ponieważ wszystkie atomy w jądrze benzenu są równoważne,
I Grupa C 6 H 5 nazywa się fenyl. Nazywane są grupy fenylowe i podstawione grupy fenylowe aryl. Niektóre pochodne benzenu przedstawiono poniżej:
Schemat reakcji dla benzenu


Izomery z dwoma podstawnikami w pozycjach 1,2; 1,3 i 1,4 nazywane są izomerami orto-, meta- i para:

Nomenklatura związków aromatycznych
Poniżej znajdują się nazwy niektórych związków aromatycznych:
C 6 H 5 NH 3 + Cl - Chlorek fenyloamoniowy (chlorek anilinowy)
C b H 5 CO 2 H Kwas benzenokarboksylowy (kwas benzoesowy)
C 6 H 5 CO 2 C 2 H 5 Ester etylowy kwasu benzenokarboksylowego (benzoesan etylu)
C 6 H 5 COCl Chlorek benzenokarbonylu (chlorek benzoilu)
C 6 H 5 CONH 2 Benzenokarboksyamid (benzamid)
C 6 H 5 CN Benzenokarbonitryl (benzonitryl)
C 6 H 5 CHO Benzenokarbaldehyd (benzaldehyd)
C 6 H 5 COCH 3 Acetofenon
C6H5OH Fenol
C 6 H 5 NH 2 Fenyloamina (anilina)
C 6 H 5 OCH 3 Metoksybenzen (anizol)
Nazwy te odpowiadają nomenklaturze IUPAC. W nawiasach znajdują się tradycyjne nazwy, które są nadal powszechnie używane i akceptowane.
Nomenklatura areny
W ten sposób konstruuje się nazwę pochodnej benzenu z dwoma lub więcej podstawnikami na pierścieniu benzenowym. Atom węgla pierścienia benzenowego, do którego przyłączony jest podstawnik najbliżej początku powyższej listy, otrzymuje liczbę 1. Ponadto atomy węgla pierścienia benzenowego są ponumerowane tak, że lokant - liczba drugiego podstawnika - jest najmniejszy.
Kwas 3-hydroksybenzenokarboksylowy (kwas 3-hydroksybenzoesowy)
Grupę karboksylową traktuje się jako grupę główną i przypisuje się jej lokant „1”. Numeracja pierścienia jest skonstruowana tak, że grupa hydroksylowa otrzymuje mniejszy ("3", nie "5") lokant.
2-aminobenzenokarbaldehyd (2-aminobenzaldehyd)
Grupa -CHO jest traktowana jako grupa główna. Otrzymuje lokant "1". Grupa NH2 znajduje się w pozycji „2”, a nie w pozycji „6”. Ponadto dopuszczalna jest nazwa o-aminobenzaldehyd.
1-bromo-2-nitro-4-chlorobenzen Te grupy są wymienione w porządku alfabetycznym.
Zdobywanie aren
Otrzymywanie z węglowodorów alifatycznych. Gdy prostołańcuchowe alkany z co najmniej 6 atomami węgla w cząsteczce przepuszcza się przez rozgrzany tlenek platyny lub chromu (III), następuje dehydrocyklizacja - tworzenie arenu z uwolnieniem wodoru. Na przykład:

2. Odwodornienie cykloalkanów. Reakcja zachodzi podczas przepuszczania oparów cykloheksanu i jego homologów przez rozgrzaną platynę:
![]()
|. Otrzymywanie benzenu przez trimeryzację acetylenu. Zgodnie z metodą N. D. Zelinsky'ego i B. A. Kazansky'ego benzen można uzyskać, przepuszczając acetylen przez rurkę z węglem aktywnym ogrzaną do 100 ° C. Cały proces można przedstawić na diagramie:

4. Otrzymywanie homologów benzenu w reakcji Friedla-Craftsa(patrz Właściwości chemiczne benzenu).
5. Fuzja soli kwasów aromatycznych z alkaliami: C6H6-COONa + NaOH® C6H6 + Na2CO3
Zastosowanie aren
Areny są wykorzystywane jako surowce chemiczne do produkcji leków, tworzyw sztucznych, barwników, pestycydów i wielu innych substancji organicznych. Areny są szeroko stosowane jako rozpuszczalniki.
Reakcje odwodornienia umożliwiają wykorzystanie węglowodorów ropopochodnych do produkcji węglowodorów serii benzenowej. Wskazują na związek między różnymi grupami węglowodorów i ich wzajemną przemianę w siebie.
Areny(węglowodory aromatyczne) - związki, których cząsteczki zawierają jeden lub więcej pierścieni benzenowych - cykliczne grupy atomów węgla o specyficznym charakterze wiązań.
Benzen - wzór cząsteczkowy C6H6. Po raz pierwszy zaproponował to A. Kekule:
Struktura areny.
Wszystkie 6 atomów węgla jest w sp 2-hybrydyzacja. Każdy atom węgla tworzy 2 σ - wiązania z dwoma sąsiednimi atomami węgla i jednym atomem wodoru, które znajdują się w tej samej płaszczyźnie. Kąty wynoszą 120°. Tych. wszystkie atomy węgla leżą na tej samej płaszczyźnie i tworzą sześciokąt. Każdy atom ma niehybrydowy r-siedlisko, na którym znajduje się niesparowany elektron. Ta orbita jest prostopadła do płaszczyzny, a zatem π - chmura elektronów jest "rozmazana" na wszystkich atomach węgla:

Wszystkie połączenia są równe. Energia koniugacji - ilość energii, którą należy wydać na zniszczenie układu aromatycznego.
To właśnie determinuje specyficzne właściwości benzenu - przejaw aromatyczności. Zjawisko to zostało odkryte przez Hückela i nazywane jest regułą Hückla.
Izomeria aren.
Areny można podzielić na 2 grupy:
- pochodne benzenu:

- skondensowane areny:

Ogólny wzór na areny to Znh 2 n -6 .
Areny charakteryzują się izomerią strukturalną, co tłumaczy się wzajemnym ułożeniem podstawników w pierścieniu. Jeśli w pierścieniu są 2 podstawniki, mogą znajdować się w 3 różnych pozycjach - orto (o-), meta (m-), para (p-):

Jeśli jeden proton zostanie „odebrany” benzenowi, powstaje rodnik - C 6 h 5, który jest nazywany rodnikiem arylowym. Pierwotniaki:

Areny nazywane są słowem „benzen”, wskazującym podstawniki w pierścieniu i ich pozycje:

Właściwości fizyczne aren.
Pierwsi członkowie serii to bezbarwne płyny o charakterystycznym zapachu. Dobrze rozpuszczają się w rozpuszczalnikach organicznych, ale są nierozpuszczalne w wodzie. Benzen jest toksyczny, ale ma przyjemny zapach. Powoduje ból i zawroty głowy, wdychanie dużych ilości oparów może spowodować utratę przytomności. Działa drażniąco na błony śluzowe i oczy.
Zdobywanie aren.
1. Z węglowodorów alifatycznych za pomocą „aromatyzacji” węglowodorów nasyconych wchodzących w skład oleju. Po przejściu przez tlenek platyny lub chromu obserwuje się dihydrocyklizację:

2. Odwodornienie cykloalkanów:

3. Z acetylenu (trimeryzacja) po przepuszczeniu przez gorący węgiel o temperaturze 600°C:

4. Reakcja Friedla-Craftsa w obecności chlorku glinu:

5. Fuzja soli kwasów aromatycznych z alkaliami:
Właściwości chemiczne aren.
Reakcje podstawienia arenu.
Rdzeń aren ma telefon komórkowy π - system, na który mają wpływ odczynniki elektrofilowe. Areny charakteryzują się substytucją elektrofilową, którą można przedstawić w następujący sposób:

Cząstka elektrofilowa jest przyciągana do π - układ pierścieniowy, wówczas między odczynnikiem tworzy się silne wiązanie x i jeden z atomów węgla, podczas gdy jedność pierścienia jest zerwana. Aby przywrócić aromatyczność, wyrzucany jest proton i 2 elektrony S-N przejdź do układu π pierścienia.
1. Halogenowanie następuje w obecności katalizatorów - bezwodnych chlorków i bromków glinu, żelaza:

2. Nitrowanie aren. Benzen reaguje bardzo wolno ze stężonym kwasem azotowym po mocnym podgrzaniu. Ale jeśli dodasz kwas siarkowy, reakcja przebiega bardzo łatwo:
3. Sulfonowanie przebiega pod wpływem 100% - kwasu siarkowego - oleum:
4. Alkilacja alkenami. W efekcie łańcuch ulega wydłużeniu, reakcja przebiega w obecności katalizatora – chlorku glinu:
Reakcje addycji arenu.
1. Uwodornienie (z katalizatorami) aren:

2. Halogenowanie rodnikowe w oddziaływaniu pary benzenu i silnego promieniowania UV. W rezultacie powstaje stały produkt - Od 6H6Cl6:

3. Utlenianie tlenem atmosferycznym. Reakcja przebiega w tlenku wanadu(V) i temperaturze 400°C:

Homologi benzenowe mają szereg różnic - na ich produktach jestem początkowym podstawnikiem w pierścieniu:
Podstawienie w pierścieniu jest możliwe tylko w obecności katalizatora (chlorku żelaza i glinu), podstawienie następuje w pozycjach orto i para względem rodnika alkilowego:

Jeśli działają silne środki utleniające (nadmanganian potasu), łańcuch alkilowy zostaje zniszczony i powstaje kwas benzoesowy:


Dodatkowe materiały na ten temat: Areny. właściwości areny.
Klasa chemii 7,8,9,10,11, USE, GIA |
|
| Podstawowe informacje o kursie chemii do edukacji i przygotowania do egzaminów, GVE, USE, OGE, GIA | |
Definicja, struktura molekularna aren.
Areny- są to związki organiczne, węglowodory o karbocyklicznym charakterze aromatycznym, w cząsteczkach których występuje jeden lub więcej pierścieni benzenowych - cykliczne grupy atomów węgla o specyficznym charakterze wiązań jądra benzenowego, które odpowiadają wzorowi ogólnemu C n H 2 n -6.
Benzen to najprostszy aren o wzorze cząsteczkowym C6H6. Formułę jako pierwszy zaproponował A. Kekule:
Budowa cząsteczek arenowych.
Wszystkie 6 atomów węgla jest w sp 2-hybrydyzacja. Każdy atom węgla tworzy 2 σ - wiązania z dwoma sąsiednimi atomami węgla i jednym atomem wodoru, które znajdują się w tej samej płaszczyźnie. Kąty wynoszą 120°. Tych. wszystkie atomy węgla leżą na tej samej płaszczyźnie i tworzą sześciokąt. Każdy atom ma niehybrydowy r-siedlisko, na którym znajduje się niesparowany elektron. Ta orbita jest prostopadła do płaszczyzny, a zatem π - chmura elektronów jest "rozmazana" na wszystkich atomach węgla:

Wszystkie połączenia są równe. Energia koniugacji - ilość energii, którą należy wydać na zniszczenie układu aromatycznego.
To właśnie determinuje specyficzne właściwości benzenu - przejaw aromatyczności. Zjawisko to zostało odkryte przez Hückela i nazywane jest regułą Hückla.
2. Izomeria aren.
Areny można podzielić na 2 grupy:
pochodne benzenu:

skondensowane areny:

Ogólna formuła aren to C n H 2n-6.
Areny charakteryzują się izomerią strukturalną, co tłumaczy się wzajemnym ułożeniem podstawników w pierścieniu. Jeśli w pierścieniu są 2 podstawniki, mogą one znajdować się w 3 różnych pozycjach - orto (o-), meta (m-), para (p-).
TEMAT 20. Węglowodory aromatyczne z serii benzenowej.
szereg homologiczny. Ogólna formuła. Nomenklatura. Izomeria.
Źródła naturalne i metody otrzymywania: ze związków alifatycznych, alicyklicznych i aromatycznych. Reakcje Wurtza-Fittiga i Friedla-Craftsa.
Właściwości fizyczne benzenu i jego homologów.
Właściwości chemiczne. Reakcje podstawienia elektrofilowego: halogenowanie, nitrowanie, sulfonowanie, alkilowanie i acylowanie. Reakcje addycji wodoru, halogenów, ozonu. utlenianie benzenu. Reakcje łańcuchów bocznych homologów benzenu: halogenowanie, nitrowanie, utlenianie, odwodornienie.
szereg homologiczny. Ogólna formuła.
Pierwszym i najważniejszym przedstawicielem monocyklicznych węglowodorów aromatycznych (arenów) jest benzen C6H6.
Stąd potoczna nazwa homologicznej serii węglowodorów aromatycznych - seria benzenu.
Ogólna formuła seria homologiczna benzenu: CpN2p-6.
Nomenklatura areny.
Do nazywania aren często używa się trywialnych nazw: benzen, toluen, styren, kumen itp.
Zgodnie z międzynarodową nomenklaturą podstawień areny uważane są za pochodne benzenu, w których położenie podstawników jest oznaczone liczbami, natomiast liczba atomów węgla, w których znajdują się podstawniki, powinna być najmniejsza:
metylobenzen etylobenzen izopropylobenzen
(toluen) (kumen)

winylobenzen etynylobenzen
(styren) (fenyloacetylen)
W przypadku dwóch identycznych podstawników zamiast liczb można zastosować przedrostki: 1,2- (orto-), 1,3- (meta-), 1,4- (para-):

1,2-dimetylobenzen 1,3-dimetylobenzen 1,4-dimetylobenzen
(orto-ksylen) (meta-ksylen) (para-ksylen)
- Wyrażenia irracjonalne (wyrażenia z pierwiastkami) i ich transformacja
- Opowiadanie pracy „Opowieść o tym, jak jeden człowiek nakarmił dwóch generałów” Saltykowa-Szczedrina M.
- Wasilij Ermolaevich Bugor był nawigatorem arktycznym i jednym z pionierów Syberii
- Izomery areny. Budowa cząsteczek arenowych. Stabilizacja kompleksu σ. Odbywa się to przez oddzielenie protonu od kompleksu σ za pomocą zasady. W tym przypadku, dzięki dwóm elektronom zerwania wiązania kowalencyjnego C - H, przywracany jest zamknięty układ π
- Jaki sprzęt postawić na barszcz poziom 8
- M56 Scorpion — amerykański niszczyciel czołgów VII poziomu
- Właściwości chemiczne cynku i jego związków
- Poziomy organizacji życia systemów żywych
- Jak ugotować forszmak ze śledzia w Odessie po żydowsku i w nowy sposób Forszmak ze śledzia klasyczna żydowska receptura
- Amerykańskie ciasto z dyni
- Ciasto twarogowe bez pieczenia z truskawkami
- Sałatka „Grzyby pod śniegiem” Sałatka „Grzyby pod śniegiem” - przepis krok po kroku ze zdjęciem
- Ciasteczka kruche czekoladowe ze smalcem
- Domowy kawior z cukinii w powolnej kuchence na zimę: prosty i bardzo smaczny kawior z cukinii szybki przepis w powolnej kuchence
- Pasztety mięsne z ciasta drożdżowego Nadzienie mięsne do pasztetów jak gotować
- Naleśniki z cukinii Jak zrobić naleśniki z cukinii
- Sucharki w piekarniku, temperatura
- Przepisy na pierniki dla doskonałych przepisów na pierniki z lekkim lukrem
- Jak ugotować kawior z cukinii w tradycyjny sposób iw powolnej kuchence?
- Zaklęcia, aby zadzwonić na randkę Zaklęcia, aby zadzwonić na randkę