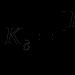Rozwiązania elektrolitycznej dysocjacji reakcji wymiany jonowej. dysocjacja elektrolityczna. Reakcje wymiany jonowej. Reakcje wymiany jonowej
Elektrolity to substancje, które w roztworze dysocjują (rozkładają się) na jony. Roztwory elektrolitów są w stanie przewodzić prąd. Aby ilościowo scharakteryzować dysocjację elektrolityczną, wprowadzono pojęcie stopnia dysocjacji.
Stopień dysocjacji to stosunek liczby cząsteczek zdysocjowanych na jony do całkowitej liczby cząsteczek substancji rozpuszczonej.
W zależności od stopnia dysocjacji wszystkie elektrolity dzielą się na mocne i słabe elektrolity. Do silnych elektrolitów należą związki o stopniu dysocjacji równym jeden, są to rozpuszczalne sole, zasady ( NaOH, KOH, LiOH, Ca(Oh) 2 ), niektóre kwasy ( CZEŚĆ, h 2 WIĘC 4 , HCl, HBr, HNO 3 ). Słabe elektrolity obejmują substancje, których stopień dysocjacji jest znacznie mniejszy niż jedność, są to woda, nierozpuszczalne i trudno rozpuszczalne sole, nierozpuszczalne zasady, NH 4 Oh, seria kwasów ( CH 3 COOH, h 2 WIĘC 3 , HNO 2 , h 2 S, HCN, h 3 PO 4 , h 2 WSPÓŁ 3 , h 2 SiO 3 , HF).
W roztworach słabych elektrolitów proces dysocjacji przebiega odwracalnie, więc można do niego zastosować prawo działania masy. Tak więc w roztworze kwasu octowego proces dysocjacji jest odwracalny:
CH 3 COOH CH 3 COO + H
stała równowagi będzie równa:
Stała równowagi dla procesu dysocjacji nazywana jest stałą dysocjacji, stałą kwasowości, stałą zasadowości, stałą jonizacji kwasowej itp.
Kwasy wielozasadowe ulegają dysocjacji etapami, a każdy etap charakteryzuje się stałą dysocjacji:
H 2 CO 3 H + + HCO 3 -

HCO 3 - H + + CO 3 -

Woda jest również słabym elektrolitem:
H 2 O H + + OH -

Tabela 1 przedstawia stałe dysocjacji wielu kwasów; dla kwasów wielozasadowych stałe dysocjacji przedstawiono w krokach.
Tabela 1.
|
tytuł |
formuła |
K d |
pK = -lgK d |
|
azotowy |
HNO 2 |
6,9∙10 −4 |
3,16 |
|
Bornaja |
H3BO3 |
7,1∙10 -10 (K 1) |
9,15 |
|
Krzemień |
H2SiO3 |
1,3∙10 −10 |
9,9 |
|
siarkawy |
H2SO3 |
1,4∙10 −2 |
1,85 |
|
Siarkowodór |
H2S |
1,0∙10 −7 |
6,99 |
|
Węgiel |
H2CO3 |
4,5∙10 −7 |
6,35 |
|
ortofosforowy |
H3PO4 |
7,1∙10 −3 5,0∙10 −13
|
2,15 12,0 |
|
Cyjanowodór |
HCN |
5,0∙10 −10 |
9,3 |
Sporządzanie równań reakcji wymiany jonowej.
W roztworach elektrolitów kierunek reakcji określa następująca zasada: reakcje jonowe przebiegają w kierunku powstawania substancji słabo rozpuszczalnych, gazów, słabych elektrolitów i jonów złożonych, reakcje są praktycznie nieodwracalne. Ta zasada jest łatwa do wyjaśnienia, ponieważ w wyniku tych reakcji jeden lub więcej jonów jest usuwanych ze sfery reakcyjnej, co zgodnie z zasadą La Chateliera prowadzi do bardziej kompletnej reakcji chemicznej.
W takich przypadkach zaleca się zapisywanie równań reakcji w formie molekularno-jonowej (równanie molekularne, skrócone równanie jonowe), co pozwala lepiej zrozumieć istotę procesu. W równaniach molekularno-jonowych rozpuszczalne, silne elektrolity są zapisywane w postaci jonów, a słabe elektrolity i słabo rozpuszczalne substancje są zapisywane w postaci cząsteczek.
Oddziaływanie silnych elektrolitów z powstawaniem osadu:
Ba 2+ + 2Cl +2H + + SO 4 2 = BaSO 4 + 2H + + 2Cl (pełne równanie jonowe)
Ba 2+ + SO 4 2- \u003d BaSO 4 (skrócone równanie jonowe)
2) Oddziaływanie dwóch silnych elektrolitów z powstaniem elektrolitu słabego.
KCN + HCl = KCl + HCN
K + + CN + H + + Cl = K + + Cl + HCN
CN + H + = HCN
3) Oddziaływanie słabego elektrolitu z silnym:
H 2 S + Pb(NO 3) 2 = PbS + 2HNO 3
H 2 S + Pb 2+ + 2NO 3 = PbS + 2H + + 2NO 3
H 2 S + Pb 2+ \u003d PbS + 2H +
Oddziaływanie osadu z kwasem:
CaCO 3 + 2H + + 2Cl = Ca 2+ + 2Cl + H 2 O + CO 2
CaCO 3 + 2H + = Ca 2+ + H 2 O + CO 2
Część eksperymentalna.
Doświadczenie 1. Reakcje wymiany jonowej z tworzeniem osadów.
Wlej 5-6 kropli fosforanu sodu do trzech probówek i dodaj 5-6 kropli azotanu kobaltu do pierwszej probówki, 5-6 kropli siarczanu niklu do drugiej, 5-6 kropli siarczanu miedzi do trzeciej probówki. Napisz równania reakcji w postaci molekularnej i jonowej.
Do dwóch probówek wlać 5-6 kropli dwuchromianu potasu, do pierwszej dodać 5-6 kropli chlorku baru, do drugiej 5-6 kropli azotanu bizmutu. Napisz równania reakcji w postaci molekularnej i jonowej.
Na podstawie równania jonowego utwórz równanie molekularne i przeprowadź eksperyment:
Pb 2+ + 2I ─ \u003d PbI 2
3Са 2+ + 2PO 4 3– = Ca 3 (PO 4) 2
W oparciu o dostępne odczynniki otrzymuj osady wodorotlenków miedzi, kobaltu i niklu. Napisz równania reakcji w postaci molekularnej i jonowej.
Doświadczenie 2. Reakcje wymiany jonowej z tworzeniem słabego elektrolitu.
W probówce umieścić kilka kryształków octanu sodu i dodać rozcieńczony kwas siarkowy. Napisz równania reakcji w molekularnym i jonowym
Do probówki wlać kilka kropel chlorku amonu i dodać wodorotlenek potasu, zapachem określić ulatniający się gaz (jeśli nie ma zapachu, probówkę można lekko podgrzać). Napisz równanie reakcji w postaci molekularnej i jonowej.
Doświadczenie 3. Przemieszczenie równowagi jonowej.
Do dwóch probówek wlać 6-8 kropli wodorotlenku amonu, dodać 2 krople fenoloftaleiny. Następnie do jednej z probówek dodać 1 szpatułkę chlorku amonu, zanotować zmianę intensywności koloru. Wyjaśnij, jak równowaga w roztworze zmienia się po dodaniu chlorku amonu.
Do dwóch probówek wlać 6-8 kropli kwasu octowego, dodać 2 krople oranżu metylowego, do jednej z probówek dodać 1 szpatułkę octanu sodu. Porównaj intensywność koloru w probówkach. Zwróć uwagę, jak równowaga w roztworze zmienia się po dodaniu soli.
Doświadczenie 4. Zależność sukcesywnego strącania substancji słabo rozpuszczalnych w zależności od ich produktu rozpuszczalności.
W jednej probówce uzyskaj osad siarczanu ołowiu, w drugiej osad dwuchromianu ołowiu. Zwróć uwagę na kolor utworzonego osadu. Do trzeciej probówki dodać kilka kropli dwuchromianu potasu i siarczanu sodu, wymieszać roztwór i dodać 2 krople azotanu ołowiu. Określ, która substancja wytrąca się pierwsza. Na podstawie iloczynu rozpuszczalności tych soli wyjaśnij kolejność ich strącania.
Lekcja: Dysocjacja elektrolityczna. Indeks wodoru. Reakcje wymiany jonowej
Cele:
usystematyzowanie wiedzy uczniów na temat dysocjacji elektrolitycznej. Pokaż wyczyn naukowy twórców teorii. Pokaż zależność właściwości substancji od ich struktury. Zebranie wiedzy zdobytej przez studentów na ten temat w jeden system.
Zadania:
Popraw umiejętności i umiejętności kompilacji równań dysocjacji, równań jonowych, równań hydrolizy. Kształtowanie umiejętności przewidywania środowiska roztworów różnych soli. Usystematyzowanie wiedzy studentów na temat hydrolizy substancji organicznych. Rozwijanie umiejętności obserwowania, analizowania i wyciągania wniosków.
Sprzęt i odczynniki
: projektor multimedialny, komputer.
Podczas zajęć
Organizowanie czasu
Aktualizacja podstawowej wiedzy:
Uczniowie odpowiadają zgodnie z planem:
Jaka jest przewodność elektryczna roztworów?
- Dysocjacja elektrolityczna soli, zasad i kwasów.
- Mechanizm dysocjacji elektrolitycznej substancji z wiązaniem jonowym.
Wprowadzenie do nauki nowego tematu:Dlaczego roztwory kwasów, soli i zasad przewodzą prąd?
Dlaczego temperatura wrzenia roztworu elektrolitu zawsze będzie wyższa niż temperatura wrzenia roztworu nieelektrolitowego o tym samym stężeniu?
Nauka nowego materiału:
1. Pojęcie dysocjacji elektrolitycznej
W 1887 szwedzki fizykchemik Svante Arrhenius, badając przewodnictwo elektryczne roztworów wodnych, zasugerował, że w takich roztworach substancje rozkładają się na naładowane cząstki - jony, które mogą przemieszczać się do elektrod - ujemnie naładowaną katodę i dodatnio naładowaną anodę.
To jest powód, dla którego w roztworach występuje prąd elektryczny. Ten proces nazywa siędysocjacja elektrolityczna (tłumaczenie dosłowne - rozszczepienie, rozkład pod wpływem elektryczności). Ta nazwa sugeruje również, że dysocjacja zachodzi pod wpływem prądu elektrycznego. Dalsze badania wykazały, że tak nie jest: jony są tylko nośnikami ładunku w roztworze i istnieją w nim niezależnie od tego, czy prąd przepływa przez roztwór, czy nie. Przy aktywnym udziale Svante Arrheniusa sformułowano teorię dysocjacji elektrolitycznej, często nazywaną imieniem tego naukowca. Główną ideą tej teorii jest to, że elektrolity pod wpływem rozpuszczalnika spontanicznie rozkładają się na jony. I to właśnie te jony są nośnikami ładunku i odpowiadają za przewodnictwo elektryczne roztworu.
Prąd elektryczny to ukierunkowany ruch swobodnych naładowanych cząstek. Wiesz już, że roztwory i stopione sole i zasady przewodzą elektryczność, ponieważ nie składają się z obojętnych cząsteczek, ale z naładowanych cząstek - jonów. Po stopieniu lub rozpuszczeniu jony stają sięwolny nośniki ładunku elektrycznego.
Proces rozpadu substancji na wolne jony podczas jej rozpuszczania lub topienia nazywa się dysocjacją elektrolityczną.
2. Istota procesu elektrolitycznej dysocjacji soli
Istotą dysocjacji elektrolitycznej jest uwolnienie jonów pod wpływem cząsteczki wody. Rys.1. Proces rozkładu elektrolitu na jony przedstawiono za pomocą równania chemicznego. Napiszmy równanie dysocjacji dla chlorku sodu i bromku wapnia. Dysocjacja jednego mola chlorku sodu wytwarza jeden mol kationów sodu i jeden mol anionów chlorkowych.NaCl ⇄ Na+ + Cl-
Dysocjacja jednego mola bromku wapnia wytwarza jeden mol kationów sodu i dwa mole anionów bromkowych.
CaBr2 ⇄ Ca2+ + 2Br-
Uwaga: ponieważ wzór na cząstkę elektrycznie obojętną jest zapisany po lewej stronie równania, całkowity ładunek jonów musi być równy zero.
Wniosek : podczas dysocjacji soli powstają kationy metali i aniony reszty kwasowej.
3. Istota procesu elektrolitycznej dysocjacji zasad
Rozważ proces elektrolitycznej dysocjacji zasad. Napiszmy równanie dysocjacji w roztworze wodorotlenku potasu i wodorotlenku baru.
Dysocjacja jednego mola wodorotlenku potasu wytwarza jeden mol kationów potasu i jeden mol anionów wodorotlenowych.KOH ⇄ K+ + OH-
Dysocjacja jednego mola wodorotlenku baru wytwarza jeden mol kationów baru i dwa mole anionów wodorotlenowych.Ba(OH)2 ⇄ Ba2+ + 2OH-
Wniosek: podczas elektrolitycznej dysocjacji zasad powstają kationy metali i aniony wodorotlenkowe.
Zasady nierozpuszczalne w wodzie praktycznie nie ulegają dysocjacji elektrolitycznej, ponieważ są praktycznie nierozpuszczalne w wodzie, a po podgrzaniu rozkładają się tak, że nie mogą się stopić.
4. Istota procesu elektrolitycznej dysocjacji kwasów
Rozważ proces elektrolitycznej dysocjacji kwasów. Cząsteczki kwasu tworzą polarne wiązanie kowalencyjne, co oznacza, że kwasy nie składają się z jonów, ale z cząsteczek.
Powstaje pytanie – jak w takim razie kwas dysocjuje, czyli jak w kwasach tworzą się swobodne cząstki naładowane? Okazuje się, że jony powstają w kwaśnych roztworach właśnie podczas rozpuszczania.
Rozważmy proces elektrolitycznej dysocjacji chlorowodoru w wodzie, ale w tym celu opiszemy strukturę cząsteczek chlorowodoru i wody. Obie cząsteczki są utworzone przez kowalencyjne wiązanie polarne. Gęstość elektronowa w cząsteczce chlorowodoru jest przesunięta na atom chloru, a w cząsteczce wody na atom tlenu. Cząsteczka wody jest w stanie oderwać kation wodorowy od cząsteczki chlorowodoru, tworząc w ten sposób kation hydroniowy H3O+.
Wtedy równanie na dysocjację chlorowodoru wygląda tak:HCl ⇄ H+ + Cl-
5. Stopniowa dysocjacja kwasów
Stopniowa dysocjacja kwasu siarkowego
Rozważ proces elektrolitycznej dysocjacji kwasu siarkowego. Kwas siarkowy dysocjuje stopniowo, w dwóch etapach.
I–I etap dysocjacji
W pierwszym etapie jeden kation wodorowy zostaje odłączony i powstaje anion wodorosiarczanowy.
H2SO4 ⇄ H+ + HSO4-
anion wodorosiarczanowy.
II - I etap dysocjacji
W drugim etapie następuje dalsza dysocjacja anionów hydrosiarczanowych.HSO4- ⇄ H+ + SO42-
Ten etap jest odwracalny, to znaczy powstałe jony siarczanowe mogą łączyć ze sobą kationy wodorowe i przekształcać się w aniony wodorosiarczanowe. Świadczy o tym znak odwracalności.
Są kwasy, które nawet na pierwszym etapie nie dysocjują całkowicie - takie kwasy są słabe. Na przykład kwas węglowy H2CO3.
Indeks wodorowy charakteryzuje stężenie wolnych jonów wodorowych w wodzie.
Dla wygody wyświetlania wprowadzono specjalny wskaźnik, zwany pH, który jest logarytmem stężenia jonów wodorowych, mierzonym z przeciwnym znakiem, tj. pH = -log.
Mówiąc najprościej, wartość pH określa stosunek ilościowy jonów H w wodzie + i on - powstały podczas dysocjacji wody. Jeśli woda ma obniżoną zawartość wolnych jonów wodorowych (pH> 7) w porównaniu z jonami OH - , wtedy woda będzie miała odczyn zasadowy i ze zwiększoną zawartością jonów H + (pH<7)- кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
Refleksja: skomponuj cinquain
D/W:
Podsumowując lekcję
W tej lekcji nauczyłeś się, że roztwory kwasów, soli i zasad przewodzą prąd elektryczny, ponieważ po ich rozpuszczeniu powstają naładowane cząstki - jony. Ten proces nazywa się dysocjacją elektrolityczną. Podczas dysocjacji soli powstają kationy metali i aniony reszt kwasowych. Podczas dysocjacji zasad powstają kationy metali i aniony wodorotlenkowe. Podczas dysocjacji kwasów powstają kationy wodorowe i aniony reszty kwasowej.
Dysocjacja elektrolityczna- proces rozkładu elektrolitu na jony podczas jego rozpuszczania lub topienia.
Klasyczna teoria dysocjacji elektrolitycznej została stworzona przez S. Arrheniusa i W. Ostwalda w 1887 roku. Arrhenius trzymał się fizycznej teorii roztworów, nie uwzględniał oddziaływania elektrolitu z wodą i uważał, że w roztworach obecne są wolne jony. Rosyjscy chemicy I. A. Kablukov i V. A. Kistyakovsky wykorzystali chemiczną teorię roztworów D. I. Mendelejewa do wyjaśnienia dysocjacji elektrolitycznej i udowodnili, że po rozpuszczeniu elektrolitu oddziałuje chemicznie z wodą, w wyniku czego elektrolit dysocjuje na jony.
Klasyczna teoria dysocjacji elektrolitycznej opiera się na założeniu niepełnej dysocjacji substancji rozpuszczonej, charakteryzującej się stopniem dysocjacji α, tj. proporcją rozłożonych cząsteczek elektrolitu. Równowagę dynamiczną między niezdysocjowanymi cząsteczkami a jonami opisuje prawo działania masy.
Substancje rozkładające się na jony nazywane są elektrolitami. Elektrolity to substancje z wiązaniem jonowym lub silnie kowalencyjnym: kwasy, zasady, sole. inne substancje nie są elektrolitami; obejmują one substancje z niepolarnymi lub słabo polarnymi wiązaniami kowalencyjnymi; na przykład wiele związków organicznych.
Główne postanowienia TED (Teoria dysocjacji elektrolitycznej):
Cząsteczki rozpadają się na jony naładowane dodatnio i ujemnie (proste i złożone).
Pod wpływem prądu elektrycznego kationy (jony naładowane dodatnio przemieszczają się w kierunku katody (-), a aniony (jony naładowane ujemnie) w kierunku anody (+)
Stopień dysocjacji zależy od charakteru substancji i rozpuszczalnika, stężenia, temperatury.
Jeżeli stopień dysocjacji zależy od natury substancji, można sądzić, że istnieje rozróżnienie między pewnymi grupami substancji.
Duży stopień dysocjacji jest nieodłączny od silnych elektrolitów (większość zasad, soli, wiele kwasów). Warto wziąć pod uwagę, że rozpad na jony jest reakcją odwracalną. Warto również powiedzieć, że przykłady dysocjacji soli podwójnych i zasadowych nie będą w tym temacie analizowane, ich dysocjacja jest opisana w temacie „sole”.
Przykłady mocnych elektrolitów:
NaOH, K2SO4, HClO 4
Równania dysocjacji:
NaOH⇄Na + +OH -
K 2 SO 4 ⇄2K + +SO 4 2-
HClO 4 ⇄H + +ClO 4 -
Ilościową cechą wytrzymałości elektrolitów jest stopień dysocjacji (α) - stosunek stężenia molowego zdysocjowanego elektrolitu do jego całkowitego stężenia molowego w roztworze.
Stopień dysocjacji wyrażany jest w ułamkach jednostki lub w procentach. Zakres wartości wynosi od 0 do 100%.
α = 0% dotyczy nieelektrolitów (brak dysocjacji)
0% <α < 100% относится к слабым электролитам (диссоциация неполная)
α = 100% odnosi się do silnych elektrolitów (całkowita dysocjacja)
Warto też pamiętać o liczbie kroków dysocjacji, na przykład:
Dysocjacja roztworu H 2 SO 4
H 2 SO 4 ⇄ H + + HSO 4 -
HSO 4 - ⇄H + +SO 4 2-
Każdy etap dysocjacji ma swój własny stopień dysocjacji.
Na przykład dysocjacja soli CuCl 2 , HgCl 2:
CuCl 2 ⇄Cu 2+ + 2Cl - dysocjacja przebiega całkowicie
A w przypadku chlorku rtęci dysocjacja jest niepełna, a następnie niecałkowita.
HgCl 2 ⇄HgCl + +Cl -
Wracając do roztworu kwasu siarkowego, warto powiedzieć, że stopień dysocjacji obu etapów kwasu rozcieńczonego jest znacznie większy niż stężonego. Podczas dysocjacji stężonego roztworu występuje wiele cząsteczek substancji i wysokie stężenie HSO 4 - hydroanionów.
W przypadku kwasów wielozasadowych i zasad wielokwasowych dysocjacja przebiega w kilku etapach (w zależności od zasadowości).
Wymieniamy mocne i słabe kwasy i przechodzimy do równań wymiany jonowej:
Silne kwasy (HCl, HBr, HI, HClO 3 , HBrO 3 , HIO 3 , HClO 4 , H 2 SO 4 , H 2 SeO 4 , HNO 3 , HMnO 4 , H 2 Cr 2 O 7)
Słabe kwasy (HF, H 2 S, H 2 Se, HClO, HBrO, H 2 SeO 3 , HNO 2 , H 3 PO 4 , H 4 SiO 4 , HCN, H 2 CO 3 , CH 3 COOH)
Reakcje chemiczne w roztworach i stopionych elektrolitach przebiegają z udziałem jonów. W takich reakcjach stany utlenienia pierwiastków nie zmieniają się, a same reakcje są nazywane reakcje jonowymienne.
Reakcje wymiany jonowej zajdą do końca (nieodwracalnie), jeśli powstaną substancje słabo rozpuszczalne lub praktycznie nierozpuszczalne (wytrącają się), substancje lotne (uwalniane jako gazy) lub słabe elektrolity (na przykład woda).
Reakcje wymiany jonowej są zwykle zapisywane w trzech etapach:
1. Równanie molekularne
2. Uzupełnij równanie jonowe
3. Zredukowane równanie jonowe
Pisząc pamiętaj o wskazaniu opadów i gazów, a także kieruj się tabelą rozpuszczalności.
Reakcje, w których wszystkie reagenty i produkty są rozpuszczalne w wodzie, nie zachodzą.

Kilka przykładów:
Na 2 CO 3 + H 2 SO 4 → Na 2 SO 4 + CO 2 + H 2 O
2Na + +CO 3 2- +2H + +SO 4 2- →2Na + +SO 4 2- +CO 2 +H 2 O
CO 3 2- + 2H + → CO 2 + H 2 O
Skrócone równanie jonowe uzyskuje się przez wykreślenie identycznych jonów z obu stron pełnego równania jonowego.
Jeśli między dwiema solami zachodzi reakcja wymiany jonów z wytrąceniem się osadu, należy wziąć dwa wysoce rozpuszczalne odczynniki. Oznacza to, że reakcja wymiany jonowej będzie przebiegać, jeśli rozpuszczalność reagentów jest wyższa niż jednego z produktów.
Ba(NO 3) 2 + Na 2 SO 4 → BaSO 4 ↓ + 2NaNO 3
Czasami pisząc reakcje jonowymienne pomijają pełne równanie jonowe i od razu piszą skrócone.
Ba 2+ +SO 4 2- → BaSO 4 ↓
Aby uzyskać osad słabo rozpuszczalnej substancji, zawsze należy wybierać wysoce rozpuszczalne odczynniki w ich stężonych roztworach.
Na przykład:
2KF+FeCl2 →FeF2 ↓+2KCl
Fe 2+ +2F - → FeF 2 ↓
Niniejsze zasady doboru odczynników do strącania produktów obowiązują tylko dla soli.
Przykłady reakcji z wytrącaniem:
1.Ba(OH) 2 + H 2 SO 4 → BaSO 4 ↓ + 2H 2 O
Ba 2+ +SO 4 2- → BaSO 4 ↓
2. AgNO 3 +KI→AgI↓+KNO 3
Ag + +I - →AgI↓
3.H 2 S+Pb(NO 3) 2 →PbS↓+2HNO 3
H 2 S+Pb 2+ →PbS↓+2H +
4. 2KOH + FeSO 4 → Fe(OH) 2 ↓ + K 2 SO 4
Fe 2+ +2OH - →Fe(OH) 2 ↓
Przykłady reakcji z wydzielaniem gazów:
1. CaCO 3 + 2HNO 3 → Ca (NO 3) 2 + CO 2 + H 2 O
CaCO 3 + 2H + → Ca 2+ + CO 2 + H 2 O
2. 2NH 4 Cl + Ca (OH) 2 → 2NH 3 + CaCl 2 + 2H 2 O
NH4 + +OH - →NH3 +H2O
3. ZnS+2HCl→H2S+ZnCl2
ZnS+2H + →H2S+Zn2+
Przykłady reakcji z powstawaniem słabych elektrolitów:
1.Mg (CH 3 COO) 2 + H 2 SO 4 → MgSO 4 + 2CH 3 COOH
CH 3 COO - + H + → CH 3 COOH
2. HI+NaOH→NaI+H2O
H + +OH - →H2O
Rozważ zastosowanie badanego materiału do konkretnych zadań napotykanych na egzaminach:
№1
Wśród substancji: NaCl, Na 2 S, Na 2 SO 4 - reaguje z roztworem Cu (NO3) 2 wchodzi (-s)
1) tylko Na 2 S
2) NaCl i Na2S
3) Na2S i Na2SO4
4) NaCl i Na2SO4
Słowo „enter” oznacza „reakcja postępuje” i jak wspomniano powyżej, reakcja przebiega, jeśli powstaje nierozpuszczalna lub słabo rozpuszczalna substancja, uwalniany jest gaz lub powstaje słaby elektrolit (woda).
Przejrzyjmy kolejno opcje.
1) Powstał osad Cu(NO 3) 2 +Na 2 S→CuS↓+2NaNO 3 .
2) NaCl + Cu (NO 3) 2 ↛CuCl 2 + 2NaNO 3
Tylko reakcja z Na2S przebiega z utworzeniem osadu
3) W przypadku Na2S nastąpi również tworzenie osadu, jak w pierwszych dwóch przykładach.
Na 2 SO 4 +Cu(NO 3) 2 ↛CuSO 4 +2NaNO 3
Wszystkie produkty są dobrze rozpuszczalnymi elektrolitami, nie są gazami, dlatego reakcja nie przebiega.
4) Z Na 2 SO 4 reakcja nie przebiega tak jak w poprzedniej odpowiedzi
NaCl+Cu(NO3) 2 ↛CuCl 2 +2NaNO 3
Wszystkie produkty są dobrze rozpuszczalnymi elektrolitami, nie są gazami, dlatego reakcja nie przebiega.
Dlatego odpowiedni 1 Możliwa odpowiedź.
№2 . Podczas interakcji uwalniany jest gaz
1) MgCl2 i Ba (NO3) 2
2) Na 2 CO 3 i CaCl 2
3) NH4C i NaOH
4) CuSO 4 i KOH
Słowo „gaz” w takich zadaniach oznacza właśnie gazy i związki lotne.
W przypisaniach NH 3 H 2 O, H 2 CO 3 są zwykle spotykane jako takie związki (w normalnych warunkach reakcji rozkłada się na CO 2 i H 2 O, zwykle nie pisze się pełnego wzoru kwasu węglowego, ale natychmiast pomaluj go na gaz i wodę), H 2 S.
Z przedstawionych powyżej substancji nie będziemy w stanie uzyskać H 2 S, ponieważ we wszystkich substancjach nie ma jonu siarczkowego. Nie możemy również uzyskać dwutlenku węgla, ponieważ aby uzyskać go z soli, trzeba dodać kwas, a kolejna sól jest łączona z węglanem sodu.
Gaz możemy dostać w 3 opcjach.
NH4Cl + NaOH → NH3 + NaCl + H2O
Uwolnił się gaz o ostrym zapachu.
Dlatego odpowiedni 3 Możliwa odpowiedź.
№3 .Reaguje z kwasem solnym
1) azotan srebra
2) azotan baru
3) srebrny
4) tlenek krzemu
Wśród odczynników znajdują się dwa elektrolity, aby reakcja mogła zajść konieczne jest wyróżnienie osadu.
Kwas solny nie będzie reagował z tlenkiem krzemu, a srebro nie wypiera wodoru z kwasu solnego.
Ba (NO 3) 2 + 2HCl → BaCl 2 + 2HNO 3 reakcja nie przebiega, ponieważ wszystkie produkty są rozpuszczalnymi elektrolitami
AgNO 3 +HCl→AgCl↓+NaNO3
Wypadnie biały, tandetny osad azotanu srebra
Dlatego odpowiedni 1
Możliwa odpowiedź.
Poniższy przykład zadania, w przeciwieństwie do pierwszych trzech, pochodzi z KIM USE 2017.
Pierwsze trzy pochodzą z KIM OGE 2017
Ustal zgodność między formułami substancji a odczynnikiem, za pomocą którego możesz odróżnić ich roztwory wodne: dla każdej pozycji oznaczonej literą wybierz odpowiednią pozycję oznaczoną liczbą.
FORMUŁA ODCZYNNIKA SUBSTANCJI
A) HNO 3 i H 2 O 1) CaCO 3
B) KCl i NaOH 2) KOH
B) NaCl i BaCl 2 3) HCl
D) AlCl 3 i MgCl 2 4) KNO 3
Aby wykonać to zadanie, musisz najpierw zrozumieć, że pod każdą literą wskazano dwie substancje znajdujące się w tym samym roztworze i musisz wybrać substancję tak, aby co najmniej jedna z nich weszła w jakościową reakcję z substancją odczynnika, która jest podana pod numerem.
Dodaj węglan wapnia do roztworu kwasu azotowego, dwutlenek węgla stanie się oznaką reakcji:
2HNO 3 + CaCO 3 → Ca (NO 3) 2 + CO 2 + H 2 O
Ponadto, logicznie rzecz biorąc, węglan wapnia nie rozpuszcza się w wodzie, co oznacza, że nie rozpuści się również we wszystkich innych roztworach, dlatego też rozpuszczanie węglanu wapnia można dodać do oznak reakcji, oprócz wydzielania się gazu.
Rozwiązanie pod literą B można było odróżnić za pomocą kwasu solnego pod cyfrą 3, ale tylko gdyby można było zastosować wskaźnik (fenoloftaleina), który po reakcji odbarwiłby się, ponieważ alkalia zostałyby zneutralizowane .
Dlatego w roztworze OH - jon możemy rozróżnić tylko za pomocą roztworu 5 (CuSO 4)
2NaOH+CuSO 4 →Cu(OH) 2 ↓ + Na 2 SO 4
Niebieskie kryształy powstały w dwóch roztworach.
Roztwór pod literą B można również odróżnić za pomocą odczynnika nr 5, ponieważ jony siarczanowe w połączeniu z barem natychmiast wytrącają się w biały krystaliczny osad, który jest nierozpuszczalny w nadmiarze nawet z najsilniejszymi kwasami.
BaCl 2 + CuSO 4 → CuCl 2 + BaSO 4 ↓
Roztwór pod literą G łatwo odróżnić za pomocą dowolnej zasady, ponieważ zasady magnezu i glinu natychmiast wytrącają się podczas reakcji. Alkalia jest reprezentowana pod numerem 2
AlCl3 +3KOH→Al(OH)3↓+3KCl
MgCl2 +2KOH→Mg(OH)2 ↓+2KCl
Redaktor: Kharlamova Galina Nikołajewna
Dysocjacja elektrolityczna - jest to proces rozkładu cząsteczek elektrolitu na jony pod działaniem cząsteczek polarnego rozpuszczalnika.
elektrolity- Są to substancje, których roztopione lub wodne roztwory przewodzą prąd elektryczny. Należą do nich roztwory kwasów, stopów oraz roztwory zasad i soli. Nieelektrolity to substancje, które nie przewodzą prądu. Należą do nich wiele substancji organicznych.
Elektrolity, które prawie całkowicie dysocjują na jony, nazywane są mocny; elektrolity, które częściowo dysocjują na jony, nazywane są słaby. Aby określić ilościowo kompletność dysocjacji, wprowadzono pojęcie stopnia dysocjacji. Stopień dysocjacji elektrolit zwany stosunkiem liczby cząsteczek, które rozpadły się na jony, do całkowitej liczby cząsteczek w roztworze.
Zwykle stopień dysocjacji ( α ) wyrażone są w ułamkach jednostki lub %:
gdzie n to liczba cząstek poddanych dysocjacji elektrolitycznej;
n 0 to całkowita liczba cząstek w roztworze.
Silne elektrolity - prawie wszystkie sole, zasady rozpuszczalne ( NaOH, KOH, Ba(Oh) 2 itp.), kwasy nieorganiczne ( h 2 WIĘC 4 , HCl, HNO 3 , HBr, CZEŚĆ itd) .
Słabe elektrolity- nierozpuszczalne zasady i NH 4 Oh, kwasy nieorganiczne ( h 2 WSPÓŁ 3, , h 2 S, HNO 2, h 3 PO 4 itp.), kwasy organiczne i woda h 2 O.
Silne elektrolity dysocjują na jony prawie całkowicie (tzn. proces dysocjacji jest nieodwracalny) i jednoetapowo:
HCl=H + +Cl – h 2 WIĘC 4 = 2H + + SO 4 2–
Słabe elektrolity dysocjują częściowo (tzn. proces dysocjacji jest odwracalny) i stopniowo . Na przykład w przypadku kwasów wielozasadowych na każdym etapie odłączany jest jeden jon wodorowy:
1.H 2 WIĘC 3 ⇄ h + + HSO 3 - 2. HSO 3 - ⇄ h + + SO 3 2-
Tak więc liczba etapów wielozasadowych kwasów jest określona przez zasadowość kwasu (liczba jonów wodorowych), a liczba etapów zasad wielokwasowych będzie określona przez kwasowość zasady (lub liczbę grup hydroksylowych). : NH 4
Oh
⇄
NH 4
+
+
Oh –
.
Proces dysocjacji elektrolitycznej kończy się ustaleniem stanu równowagi chemicznej w układzie, który charakteryzuje się stałą równowagi: 
Stała równowagi procesu dysocjacji elektrolitycznej nazywana jest stałą dysocjacji - DO D. Stała dysocjacji zależy od natury elektrolitu, natury rozpuszczalnika, temperatury, ale nie zależy od stężenia elektrolitu.
Między DO D oraz α Istnieje związek ilościowy
 (13)
(13)
Relacja (13) nazywana jest prawem rozcieńczenia Ostwalda: stopień dysocjacji słabego elektrolitu wzrasta wraz z rozcieńczeniem roztworu.
Dla słabych elektrolitów, gdy α 1, DO D = α 2 Z.
Woda jest słabym elektrolitem, dlatego dysocjuje odwracalnie:
h 2 O ⇄ h + + Oh – ∆ h\u003d + 56,5 kJ / mol
Stała dysocjacji wody: 
Stopień dysocjacji wody jest bardzo mały (jest to bardzo słaby elektrolit). Ponieważ woda występuje w dużym nadmiarze, jej stężenie można uznać za wartość stałą i wynosi  , następnie
, następnie
DO D [ h 2 O] = [ h + ]∙[ Oh - ] = 55,6∙1,8∙10 -16 = 10 -14
[ h + ]∙[ Oh - ] = 10 -14 = K W jest produktem jonowym wody
Ponieważ stężenia kationów wodorowych i jonów wodorotlenowych są równe w wodzie, to: [
h +
]
= [
Oh -
]
=
 .
.
Rozpuszczanie innych substancji (kwasów, zasad, soli) w wodzie zmienia stężenie jonów h + lub ON – , a ich produkt zawsze pozostaje stały i równy 10 -14 przy T \u003d 25 0 C. Stężenie jonów h + może służyć jako miara kwasowości lub zasadowości roztworu. Zwykle do tego celu stosuje się wskaźnik pH: pH = - LG[ h + ]. W ten sposób, wartość PH jest logarytmem dziesiętnym stężenia jonów wodorowych, wziętym z przeciwnym znakiem.
W zależności od stężenia jonów wodorowych rozróżnia się trzy media.
V neutralnyśrodowisko [ h + ] = [ Oh - ]= 10 -7 mol/l, pH= –LG 10 -7 = 7 . To medium jest typowe zarówno dla czystej wody, jak i roztworów neutralnych. V kwaśny rozwiązania [ h + ] > 10 -7 mol/l, pH< 7 . W środowisku kwaśnym pH zmienia się w granicach 0 < рН < 7 . V alkalicznyśrodowiska [ h + ] < [ОН – ] oraz [ h + ] < 10 -7 mol/l, W związku z tym, pH > 7. Granice zmiany pH: 7 < рН < 14 .
Reakcje wymiany jonowej (RIO)- są to reakcje między jonami zachodzącymi w wodnych roztworach elektrolitów. Charakterystyczną cechą reakcji wymiany jest to, że pierwiastki tworzące reagenty nie zmieniają swojego stanu utlenienia. Reakcje wymiany jonowej są reakcjami nieodwracalnymi i przebiegają pod warunkiem, że: 1) tworzenie się słabo rozpuszczalnej substancji, 2) uwalnianie substancji gazowej, 3) tworzenie słabego elektrolitu.
Kiedy występuje RIO, przeciwnie naładowane jony są wiązane i usuwane ze sfery reakcyjnej. Istotę reakcji wymiany jonowej wyraża się za pomocą równań jonowych, które w przeciwieństwie do molekularnych pokazują prawdziwych uczestników reakcji. Podczas kompilowania równań jonowych należy kierować się faktem, że substancje lekko dysocjujące, słabo rozpuszczalne (wytrącające) i gazowe są zapisane w postaci molekularnej. Silnie rozpuszczalne elektrolity są zapisywane jako jony. Dlatego przy pisaniu równań jonowych konieczne jest posługiwanie się tabelą rozpuszczalności soli i zasad w wodzie.
Hydroliza- jest to proces oddziaływania jonów soli z cząsteczkami wody, prowadzący do powstania związków niskodysocjujących; jest szczególnym przypadkiem reakcji wymiany jonowej. Hydroliza ulega tworzeniu soli:
słaby kwas i mocna zasada ( NaCH 3 GRUCHAĆ, Na 2 WSPÓŁ 3 , Na 2 S, );
słaba zasada i mocny kwas NH 4 Cl, FeCl 3 , AlCl 3 ,);
słaba zasada i słaby kwas NH 4 CN, NH 4 CH 3 GRUCHAĆ).
Sole utworzone przez mocny kwas i mocną zasadę nie ulegają hydrolizie: Na 2 WIĘC 4 , BaCl 2 , NaCl, NaJ itp.
Hydroliza soli zwiększa stężenie jonów h + lub ON – . Prowadzi to do zmiany równowagi jonowej wody i, w zależności od charakteru soli, nadaje rozwiązaniu kwasowe lub zasadowe środowisko (patrz przykłady rozwiązywania problemów).
Cel. Zdobycie umiejętności zestawiania molekularnych i jonowych równań reakcji zachodzących w roztworach elektrolitów. Naucz się określać kierunek reakcji jonowych.
Gdy niektóre substancje rozpuszczają się w wodzie (lub innych rozpuszczalnikach polarnych), pod wpływem cząsteczek rozpuszczalnika cząsteczki tej substancji rozkładają się na jony. W wyniku tego procesu roztwór zawiera nie tylko cząsteczki rozpuszczalnika i substancji rozpuszczonej, ale także powstałe jony. Roztwory substancji, które rozkładają się na jony po rozpuszczeniu w wodzie lub innych rozpuszczalnikach polarnych, nazywane są elektrolitami.
Proces rozkładu cząsteczek substancji rozpuszczonej (elektrolitu) na jony pod działaniem cząsteczek polarnego rozpuszczalnika nazywa się dysocjacją elektrolityczną.
Roztwory elektrolitów mają jonową przewodność elektryczną (jony biorą udział w przenoszeniu ładunków elektrycznych) i są przewodnikami drugiego rodzaju.
Ilościową charakterystyką procesu rozkładu substancji rozpuszczonej na jony jest stopień dysocjacji elektrolitycznej - α. Stopień dysocjacji to stosunek liczby cząsteczek substancji rozpuszczonej rozłożonych na jony w roztworze (n) do całkowitej liczby cząsteczek rozpuszczonych (N):
Stopień dysocjacji elektrolitycznej jest określany empirycznie i wyrażany w ułamkach jednostki lub w procentach. Stopień dysocjacji elektrolitu zależy od charakteru elektrolitu, stężenia i temperatury.
W zależności od stopnia dysocjacji elektrolitu w roztworze o kon-
równoważne stężenie równe 0,1 mol / l (0,1 n.), roztwory warunkowo
podzielony na trzy grupy: elektrolity mocne, słabe i średnie. Jeśli w
0,1 N roztwór elektrolitu α > 0,3 (30 \%) elektrolit jest uważany za silny, α ≤ 0,03 (3 \%) - słaby elektrolit. Elektrolity o pośrednich wartościach stopnia dysocjacji są uważane za średnie.
Za mocne elektrolity, jeśli rozpuszczalnikiem jest woda, w stosunku do
– kwasy: НNO3, H2SO4, НCNS, НCl, НClO3, HClO4, HBr, HBrО3, HBrО4, НI, НIO3 HMnO4, H2SeO4, HReO4, HTcO4; a także kwasy H2CrO4, H4P2O7, H2S2O6, które są silne w pierwszym etapie dysocjacji, czyli oderwaniu pierwszego jonu H+;
– zasady: wodorotlenki metali alkalicznych (Li, Na, K, Rb, Cs, Fr) i metali ziem alkalicznych (Ca, Sr, Ba, Ra): LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2 , Ba(OH)2, Sr(OH)2; Ra(OH)2; jak również T10OH;
większość soli. Wyjątek: Fe(SCN)3, Mg(CN)2, HgCl2, Hg(CN)2.
Słabe elektrolity to:
– kwasy: H2CO3, HClO, H2S, H3BO3, HCN, H2SO3, H2SiO3, CH3COOH, HCOOH, H2C2O4 itp. (Załącznik, Tabela 2);
– zasady (p- i d-pierwiastki): Be(OH)2, Mg(OH)2, Fe(OH)2, Zn(OH)2; wodorotlenek amonu NH4OH oraz zasady organiczne – aminy (CH3NH2) i amfolity (H3N+CH2COOˉ).
Woda jest bardzo słabym elektrolitem (H2O) α = 2 10-9, tj.
cząsteczki wody mogą również rozkładać się na jony w wyniku wzajemnego oddziaływania cząsteczek.
Silne elektrolity to substancje, które po rozpuszczeniu w wodzie całkowicie rozkładają się na jony, czyli prawie całkowicie dysocjują. Po zerwaniu wiązania między jonami w cząsteczce elektrolitu pod wpływem cząsteczek wody, powstałe jony otaczają się cząsteczkami wody i dlatego znajdują się w roztworze w stanie uwodnionym. Uwzględniając hydratację jonów, równanie dysocjacji elektrolitycznej można zapisać w następujący sposób:
|
|
Równanie dysocjacji dla silnego elektrolitu jest napisane w uproszczony sposób,
Na przykład:
NaCl → Na+ + Clˉ;
HNO3 → H+ + NO3ˉ;
Ba(OH)2 → Ba2+ + 2OHˉ
Słabe elektrolity obejmują substancje, które po rozpuszczeniu w wodzie częściowo dysocjują na jony. Równowaga ustala się między jonami, których stężenie w roztworze jest niskie, a faktycznie istniejącymi niezdysocjowanymi cząsteczkami:
CH3COOH 5 CH3COO3 + H+; H2O oznacza H+ + OH4.
Ten zapis oznacza, że w rozwiązaniu jednocześnie zachodzą dwa procesy.
proces: rozpad cząsteczek na jony i tworzenie cząsteczek z jonów. Równowaga w roztworach słabych elektrolitów przesuwa się w kierunku produktów wyjściowych, dlatego słabe elektrolity w roztworze występują głównie w postaci cząsteczek.
Właściwości chemiczne roztworów elektrolitów zależą od właściwości jonów i cząsteczek obecnych w roztworze. Kierunek reakcji między jonami a cząsteczkami w roztworach elektrolitów determinowany jest możliwością powstawania substancji słabo rozpuszczalnych lub słabych elektrolitów. Jeżeli reakcja nie prowadzi do powstania słabo rozpuszczalnej substancji lub słabego elektrolitu, to taka reakcja nie może przebiegać. Na przykład, gdy wlewa się roztwory azotanu sodu i chlorku potasu, reakcja nie przebiega, ponieważ żadna słabo rozpuszczalna substancja lub słaby elektrolit nie może powstać z jonów w roztworze w reakcji wymiany. Sole te są silnymi elektrolitami i są dobrze rozpuszczalne w wodzie, więc roztwór będzie zawierał
mieszanina jonów:
Na+ + NO3ˉ + K+ + Clˉ,
z których składały się oryginalne substancje. Dlatego w tym przypadku nie można napisać równania molekularnego dla reakcji wymiany
NaNO3 + KCl ≠ KNO3 + NaCl.
Reakcję zachodzącą w roztworze można przedstawić jako:
równanie reakcji molekularnej;
Równanie jonowo-molekularne (pełne lub zredukowane).
Równanie reakcji zawierające tylko wzory substancji niezdysocjowanych nazywa się równaniem molekularnym. Forma molekularna równania pokazuje, które substancje iw jakiej ilości biorą udział w reakcji. Pozwala na wykonanie niezbędnych obliczeń związanych z tą reakcją. Równanie zawierające wzory niezdysocjowanych słabych elektrolitów i jonów silnych elektrolitów nazywa się pełnym równaniem reakcji jonowej lub jonowo-molekularnej.
Redukując te same produkty w lewej i prawej części równania reakcji jonowo-molekularnej, otrzymujemy skrócone lub krótkie równanie reakcji jonowej. Równanie jonowe, które nie zawiera tych samych substancji (jonów lub cząsteczek) w lewej i prawej części reakcji, nazywa się zredukowanym lub krótkim równaniem reakcji jonowej. To równanie odzwierciedla istotę zachodzącej reakcji.
Pisząc równania reakcji jonowych, należy pamiętać:
1) mocne elektrolity należy zapisać jako oddzielne
tworzące je jony;
2) należy spisać słabe elektrolity i substancje słabo rozpuszczalne
tworzyć w postaci cząsteczek.
Jako przykład rozważ interakcję sody z kwasem. W równaniu reakcji molekularnej początkowe substancje i produkty reakcji są zapisane w postaci cząsteczek:
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O.
Biorąc pod uwagę, że w roztworze wodnym cząsteczki elektrolitu
jony rozpadają się na jony, pełne równanie jonowe tej reakcji ma postać
CO2–W równaniu jonowym słabe elektrolity, gazy i słabo rozpuszczalne substancje są zapisywane jako cząsteczki. Znak ↓ przy wzorze substancji oznacza, że substancja ta jest usuwana ze sfery reakcji w postaci
osad, a znak oznacza, że substancja jest usuwana ze sfery reakcyjnej w postaci gazu.
Substancje, których cząsteczki całkowicie dysocjują na jony (silne elektrolity), są zapisywane jako jony. Suma ładunków elektrycznych po lewej stronie równania musi być równa sumie ładunków elektrycznych po prawej stronie.
Pisząc równania jonowe należy kierować się tabelą rozpuszczalności kwasów, zasad i soli w wodzie, tzn. należy sprawdzić rozpuszczalność odczynników i produktów, zaznaczając to w równaniach, a także w tabeli stałych dysocjacji słabych elektrolitów (Załącznik, Tabele 1 i 2). Rozważmy przykłady pisania niektórych równań jonowo-molekularnych.
Przykład 1. Powstawanie trudnych i słabo rozpuszczalnych związków (osad).
a) Powstawanie siarczanu baru
Równanie reakcji molekularnej:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl.
Pełne równanie reakcji jonowej (jonowo-molekularnej):
Ba2+ + 2Clˉ + 2Na+ + SO4 ˉ = BaSO4↓ + 2Na
CO2–CO2 + H2O (skrócone równanie jonowe).
Przykład 3. Powstawanie słabego elektrolitu.
2Na+ + 2OH– +2H+ + SO 2–(pełne równanie jonowe)
2OH– + 2H+ = 2H2O (skrócone równanie jonowe).
Reakcja neutralizacji mocnego kwasu mocną zasadą sprowadza się do oddziaływania jonów wodorowych z jonami wodorotlenkowymi;
b) słaby kwas:
2NaNO2 + H2SO4 = 2HNO2 + Na2SO4 (równanie molekularne)
NH+(pełne równanie jonowe)
NH4OH (skrócone równanie jonowe).
Silne zasady wypierają słabe zasady z ich soli.
Przykład 4. Gdy wśród związków wyjściowych i produktów reakcji znajduje się słaby elektrolit lub słabo rozpuszczalna substancja, wówczas równanie wykorzystuje -
Znak równowagi Xia „⇄”. Równowaga w reakcji przesuwa się w kierunku słabszego elektrolitu lub słabo rozpuszczalnej substancji, co oznacza
ikona (↷)..
a) CH3COOH + NaOH CH3COONa + H2O
CH3COOH + OHˉ CH3COOˉ + H2O (↷).
W wyniku reakcji powstaje słabszy elektrolit - woda. Równy-
jest to przesunięte w kierunku bezpośredniej reakcji.
b) CaSO4↓ + Na2CO3 CaCO3↓ + Na2SO4;
|
|
⇄ CaCO3↓ + 2 Na+
W wyniku reakcji powstaje mniej rozpuszczalna sól – węglan wapnia
cji. Równowaga przesuwa się w kierunku reakcji bezpośredniej.
Przykład 5. Napisz trzy możliwe równania reakcji molekularnych,
odpowiadające zredukowanemu równaniu jonowemu: CH3COO– + H+ = CH3COOH.
Rozwiązanie. Wolne jony CH3COO– i H+ są wskazane po lewej stronie równania jonowego. Jony te powstają podczas dysocjacji wszelkich rozpuszczalnych mocnych elektrolitów. CH3COO– jony mogą powstawać w wyniku dysocjacji np. soli KCH3COO, NaCH3COO, Mg(CH3COO)2; dawcy jodu
nowy H+ może być dowolnym mocnym kwasem. równania reakcji molekularnych,
któremu odpowiada to równanie molekularno-jonowe, może być:
1. KCH3COO + HCl = CH3COOH + KCl;
2. NaCH3COO + HNO3 = CH3COOH + NaNO3;
3. Mg(CH3COO)2 + H2SO4 = 2 CH3COOH + MgSO4.
Bezpieczeństwo
1. Zachowaj szczególną ostrożność podczas pracy z roztworami kwasów i zasad, nie dopuszczaj do ich kontaktu ze skórą i odzieżą.
2. Jeżeli podczas eksperymentu zostanie uwolniony toksyczny produkt gazowy, należy przeprowadzić eksperyment pod wyciągiem z włączoną wentylacją.
3. Zachowaj ostrożność podczas pracy z toksycznymi solami i ich roztworami (sole baru, chromu, miedzi itp.).
- Wyrażenia irracjonalne (wyrażenia z pierwiastkami) i ich transformacja
- Opowiadanie pracy „Opowieść o tym, jak jeden człowiek nakarmił dwóch generałów” Saltykowa-Szczedrina M.
- Wasilij Ermolaevich Bugor był nawigatorem arktycznym i jednym z pionierów Syberii
- Izomery areny. Budowa cząsteczek arenowych. Stabilizacja kompleksu σ. Odbywa się to przez oddzielenie protonu od kompleksu σ za pomocą zasady. W tym przypadku, dzięki dwóm elektronom zerwania wiązania kowalencyjnego C - H, przywracany jest zamknięty układ π
- Jaki sprzęt postawić na barszcz poziom 8
- M56 Scorpion — amerykański niszczyciel czołgów VII poziomu
- Właściwości chemiczne cynku i jego związków
- Poziomy organizacji życia systemów żywych
- Jak ugotować forszmak ze śledzia w Odessie po żydowsku i w nowy sposób Forszmak ze śledzia klasyczna żydowska receptura
- Amerykańskie ciasto z dyni
- Ciasto twarogowe bez pieczenia z truskawkami
- Sałatka „Grzyby pod śniegiem” Sałatka „Grzyby pod śniegiem” - przepis krok po kroku ze zdjęciem
- Ciasteczka kruche czekoladowe ze smalcem
- Domowy kawior z cukinii w powolnej kuchence na zimę: prosty i bardzo smaczny kawior z cukinii szybki przepis w powolnej kuchence
- Pasztety mięsne z ciasta drożdżowego Nadzienie mięsne do pasztetów jak gotować
- Naleśniki z cukinii Jak zrobić naleśniki z cukinii
- Sucharki w piekarniku, temperatura
- Przepisy na pierniki dla doskonałych przepisów na pierniki z lekkim lukrem
- Jak ugotować kawior z cukinii w tradycyjny sposób iw powolnej kuchence?
- Zaklęcia, aby zadzwonić na randkę Zaklęcia, aby zadzwonić na randkę