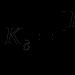Zastosowanie alkanów alkenów alkinów. Właściwości fizyczne alkenów, zastosowanie, metody otrzymywania. Nazwa alkinów i ich właściwości
DEFINICJA
Alkeny- węglowodory nienasycone, których cząsteczki zawierają jedno wiązanie podwójne; alkeny mają przyrostek -ene lub -ylene.
Ogólny wzór homologicznego szeregu alkenów (tabela 2) to C n H 2n
Tabela 2. Homologiczne serie alkenów.
Rodniki węglowodorowe utworzone z alkenów: -CH \u003d CH 2 - winyl i -CH 2 -CH \u003d CH 2 - allil.
Dla alkenów, począwszy od butenu, charakterystyczna jest izomeria szkieletu węglowego:
CH2-C (CH3)-CH3(2-metylopropen-1)
oraz pozycje z podwójnym wiązaniem:
CH2 \u003d CH-CH2-CH3 (buten-1)
CH 3-C \u003d CH-CH 3 (buten-2)
Alkeny, począwszy od butenu-2, charakteryzują się izomerią geometryczną (cis-trans) (ryc. 1).
Ryż. 1. Geometryczne izomery butenu-2.
Alkeny, poczynając od propenu, charakteryzują się izomerią międzyklasową z cykloalkanami. Tak więc skład C 4 H 8 odpowiada substancjom z klasy alkenów i cykloalkanów - buten-1 (2) i cyklobutan.
Atomy węgla w cząsteczkach alkenu są w hybrydyzacji sp 2 : wiązania 3σ znajdują się w tej samej płaszczyźnie pod kątem 120 względem siebie, a wiązanie π tworzą p elektrony sąsiednich atomów węgla. Wiązanie podwójne to kombinacja wiązań σ i π.
Właściwości chemiczne alkenów
Większość reakcji chemicznych alkenów przebiega według mechanizmu addycji elektrofilowej:
- hydrohalogenowanie - oddziaływanie alkenów z halogenowodorami (HCl, HBr), przebiegające zgodnie z regułą Markownikowa (gdy polarne cząsteczki typu HX są przyłączone do niesymetrycznych alkenów, wodór jest przyłączony do bardziej uwodornionego atomu węgla wiązaniem podwójnym)
CH 3-CH \u003d CH 2 + HCl \u003d CH 3-CHCl-CH 3
- hydratacja - oddziaływanie alkenów z wodą w obecności kwasów mineralnych (siarkowego, fosforowego) z tworzeniem alkoholi, przebiegające zgodnie z regułą Markownikowa
CH 3 -C (CH 3) \u003d CH 2 + H 2 O \u003d CH 3 -C (CH 3) OH-CH 3
- halogenowanie - oddziaływanie alkenów z halogenami np. z bromem, w którym woda bromowa ulega odbarwieniu
CH 2 \u003d CH 2 + Br 2 \u003d BrCH 2 -CH 2 Br
Gdy mieszaninę alkenu i halogenu ogrzewa się do 500C, atom wodoru alkenu można zastąpić mechanizmem rodnikowym:
CH3-CH \u003d CH2 + Cl2 \u003d Cl-CH2-CH \u003d CH2 + HCl
Uwodornienie alkenów przebiega zgodnie z mechanizmem rodnikowym. Warunkiem zajścia reakcji jest obecność katalizatorów (Ni, Pd, Pt) oraz podgrzanie mieszaniny reakcyjnej:
CH2 \u003d CH2 + H2 \u003d CH3-CH3
Alkeny są zdolne do utleniania się do różnych produktów, których skład zależy od warunków reakcji utleniania. Tak więc podczas utleniania w łagodnych warunkach (środkiem utleniającym jest nadmanganian potasu) wiązanie π zostaje zerwane i powstają alkohole dwuwodorotlenowe:
3CH 2 \u003d CH 2 + 2KMnO 4 + 4H 2 O \u003d 3CH 2 (OH) -CH 2 (OH) + 2MnO 2 + 2KOH
Podczas twardego utleniania alkenów wrzącym roztworem nadmanganianu potasu w środowisku kwaśnym dochodzi do całkowitego zerwania wiązania (wiązania σ) z utworzeniem ketonów, kwasów karboksylowych lub dwutlenku węgla:
Utlenianie etylenu tlenem w temperaturze 200C w obecności CuCl2 i PdCl2 prowadzi do powstania aldehydu octowego:
CH2 \u003d CH2 + 1/2O2 \u003d CH3 -CH \u003d O
Alkeny ulegają reakcjom polimeryzacji. Polimeryzacja - proces powstawania związku o dużej masie cząsteczkowej - polimeru - poprzez łączenie się ze sobą za pomocą głównych wartościowości cząsteczek pierwotnej substancji o niskiej masie cząsteczkowej - monomeru. Polimeryzacja może być spowodowana ciepłem, ultrawysokim ciśnieniem, promieniowaniem, wolnymi rodnikami lub katalizatorami. Tak więc polimeryzacja etylenu zachodzi pod działaniem kwasów (mechanizm kationowy) lub rodników (mechanizm rodnikowy):
n CH 2 \u003d CH 2 \u003d - (-CH 2 -CH 2 -) n -
Właściwości fizyczne alkenów
W normalnych warunkach C 2 -C 4 - gazy, C 5 -C 17 - ciecze, począwszy od C 18 - ciała stałe. Alkeny są nierozpuszczalne w wodzie, rozpuszczalne w rozpuszczalnikach organicznych.
Otrzymywanie alkenów
Główne sposoby pozyskiwania alkenów:
— dehydrohalogenowanie chlorowcopochodnych alkanów pod działaniem alkoholowych roztworów alkaliów
CH 3-CH 2-CHBr-CH 3 + KOH \u003d CH 3-CH \u003d CH-CH 3 + KBr + H 2 O
— dehalogenacja dichlorowcowanych alkanów pod działaniem metali aktywnych
CH3-CHCl-CHCl-CH3 + Zn = ZnCl2 + CH3-CH = CH-CH3
- odwadnianie alkoholi po ich podgrzaniu kwasem siarkowym (t > 150 C) lub przepuszczeniu nad katalizatorem par alkoholu
CH 3-CH (OH) - CH 3 \u003d CH 3-CH \u003d CH 2 + H 2 O
- odwodornienie alkanów po podgrzaniu (500C) w obecności katalizatora (Ni, Pt, Pd)
CH 3 -CH 2 - CH 3 \u003d CH 3 -CH \u003d CH 2 + H 2
Alkeny są wykorzystywane jako surowce do produkcji materiałów polimerowych (tworzywa sztuczne, gumy, folie) oraz innych substancji organicznych.
Przykłady rozwiązywania problemów
PRZYKŁAD 1
| Ćwiczenie | Ustaw wzór cząsteczkowy alkenu, jeśli wiadomo, że ta sama ilość, oddziałując z halogenami, tworzy odpowiednio 56,5 g dichloropochodnej lub 101 g dibromopochodnej. |
| Rozwiązanie | Właściwości chemiczne alkenów determinowane są ich zdolnością do dodawania substancji przez mechanizm addycji elektrofilowej, podczas gdy wiązanie podwójne zamienia się w wiązanie pojedyncze: CnH 2 n + Cl 2 → CnH 2 nCl 2 CnH 2 n + Br 2 → CnH 2 nBr 2 Masa przereagowanego alkenu jest taka sama, co oznacza, że w reakcji uczestniczy ta sama liczba moli alkenu. Liczbę moli węglowodoru wyrażamy, jeśli masa molowa pochodnej dichloro wynosi 12n + 2n + 71, masa molowa pochodnej dibromo wynosi (12n + 2n + 160): m (CnH 2 nCl 2) \ (12n + 2n + 71) \u003d m (CnH 2 nBr 2) \ (12n + 2n + 160) 56,5 \ (12n+2n+71) = 101 \ (12n+2n+160) Dlatego alken ma wzór C3H6 oznacza propen. |
| Odpowiedź | Formuła alkenu C 3 H 6 to propen |
PRZYKŁAD 2
| Ćwiczenie | Przeprowadź serię przekształceń etan → eten → etanol → eten → chloroetan → butan |
| Rozwiązanie | Aby otrzymać eten z etanu, konieczne jest zastosowanie reakcji odwodornienia etanu, która zachodzi w obecności katalizatora (Ni, Pd, Pt) i po podgrzaniu: C2H6 → C2H4 + H2 Produkcja etanolu z etenu odbywa się poprzez reakcję hydratacji płynącej z wodą w obecności kwasów mineralnych (siarkowy, fosforowy): C 2 H 4 + H 2 O \u003d C 2 H 5 OH Aby uzyskać eten z etanolu, stosuje się reakcję odwodornienia: C 2 H 5 OH → (t, H 2 SO 4) → C 2 H 4 + H 2 O Produkcja chloroetanu z etenu odbywa się w reakcji hydrohalogenacji: C 2 H 4 + HCl → C 2 H 5 Cl Do uzyskania butanu z chloroetanu stosuje się reakcję Wurtza: 2C2H5Cl + 2Na → C4H10 + 2NaCl |
Płoną.
1. Spalanie w powietrzu
2. Utlenianie wodnym roztworem nadmanganianu (reakcja Wagnera)
W środowisku obojętnym otrzymuje się brązowy tlenek manganu (IV), a do podwójnego wiązania substancji organicznej przyłączane są dwie grupy OH:
Po lewej stronie znajduje się alken z nadmanganianem potasu, po prawej alkan. Warstwa organiczna (górna) nie miesza się z warstwą wodną (dolna). Po prawej kolor nadmanganianu nie uległ zmianie. Ryż. jeden.

Ryż. 1. Reakcja Wagnera
3. Utlenianie zakwaszonym roztworem nadmanganianu
W środowisku kwaśnym roztwór staje się bezbarwny: Mn +7 redukuje się do Mn +2. Odbarwienie zakwaszonego roztworu nadmanganianu potasu - jakościowa reakcja na związki nienasycone.
5CH2 \u003d CH2 + 12KMnO4 + 18H2SO4 \u003d 12MnSO4 + 10CO2 + 6K2SO4 + 28H2O.
Zależność produktów utleniania od struktury alkenu:

Radykalne podstawienie w alkenach
Propen i chlor w wysokiej temperaturze 400-500 o C (warunki sprzyjające reakcji rodnikowej) dają produkt nie addycji, ale substytucji.
W przemyśle alkeny są otrzymywane przez kraking lub odwodornienie alkanów ropy naftowej.
Metody laboratoryjne otrzymywanie alkenów na podstawie reakcji rozszczepiania.
1. Dehalogenacja
Reakcja dihaloalkanów, w cząsteczkach których atomy halogenu znajdują się przy sąsiednich atomach węgla, z magnezem lub cynkiem prowadzi do powstania wiązania podwójnego:
CH 2 Cl-CH 2 Cl + Zn → CH 2 \u003d CH 2 + ZnCl 2
2. Dehydrohalogenacja
Gdy haloalkany reagują z gorącym alkoholowym roztworem zasady, cząsteczka halogenowodoru zostaje odszczepiona i powstaje alken:
CH3-CH2-CHCl-CH3 + alkohol KOH. CH 3-CH \u003d CH-CH 3 + KCl + H 2 O
3. Odwodnienie
Ogrzewanie alkoholi stężonym kwasem siarkowym lub fosforowym prowadzi do eliminacji wody i powstania alkenu.
Reakcje eliminacji niesymetrycznych haloalkanów i alkoholi często przebiegają zgodnie z: Reguła Zajcewa: Atom wodoru jest głównie oddzielony od atomów C, które są związane z najmniejszą liczbą atomów H.
Regułę Zajcewa, podobnie jak regułę Markownikowa, można wyjaśnić, porównując stabilność cząstek pośrednich, które powstają w reakcji.
Etylen, propen i buteny są materiałami wyjściowymi do syntezy petrochemicznej, przede wszystkim do produkcji tworzyw sztucznych.
Po dodaniu chloru do alkenów otrzymuje się pochodne chloru.
CH2 \u003d CH-CH3 +Cl 2 → CH 2 Cl- CHCl- CH 3 (1,2-dichloropropan)
Ale już w 1884 roku rosyjski naukowiec Lwów M.D. (rys. 2) przeprowadził reakcję chlorowania propenu w cięższych warunkach, w t = 400 0 C. W rezultacie produktem nie był dodatek chloru, ale substytucja.
CH2 \u003d CH-CH3 +Cl 2 CH2 \u003d CH-CH2Cl + HCl

Ryż. 2. Rosyjski naukowiec M.D. Lwów
Interakcja tych samych substancji w różnych warunkach prowadzi do różnych wyników. Ta reakcja jest szeroko stosowana do otrzymywania glicerolu. Czasami w sklepach warzywnych stosuje się etylen, aby przyspieszyć dojrzewanie owoców.
Podsumowując lekcję
W tej lekcji omówiłeś temat „Alkeny. Właściwości chemiczne - 2. Otrzymywanie i zastosowanie alkenów. Podczas lekcji mogłeś pogłębić swoją wiedzę na temat alkenów, poznałeś właściwości chemiczne alkenów, a także cechy otrzymywania i stosowania alkenów.
Bibliografia
1. Rudzitis G.E. Chemia. Podstawy chemii ogólnej. Klasa 10: podręcznik dla instytucji edukacyjnych: poziom podstawowy / G. E. Rudzitis, F.G. Feldmana. - 14. edycja. - M.: Edukacja, 2012.
2. Chemia. Klasa 10. Poziom profilu: podręcznik. dla kształcenia ogólnego instytucje / V.V. Eremin, N.E. Kuzmenko, W.W. Lunin i in. - M.: Drofa, 2008. - 463 s.
3. Chemia. Klasa 11. Poziom profilu: podręcznik. dla kształcenia ogólnego instytucje / V.V. Eremin, N.E. Kuzmenko, W.W. Lunin i in. - M.: Drofa, 2010r. - 462 s.
4. Khomchenko GP, Khomchenko I.G. Zbiór problemów z chemii dla osób wkraczających na uniwersytety. - 4 wyd. - M .: RIA "Nowa fala": Wydawnictwo Umerenkov, 2012. - 278 s.
Praca domowa
1. Nr 12, 13 (s. 39) Rudzitis G.E., Feldman F.G. Chemia: Chemia organiczna. Klasa 10: podręcznik dla instytucji edukacyjnych: poziom podstawowy / G. E. Rudzitis, F.G. Feldmana. - 14. edycja. - M.: Edukacja, 2012.
2. Jaka jest reakcja jakościowa dla etylenu i jego homologów?
3. Czy podczas chlorowania propenu nie może nastąpić dodawanie, ale zastąpienie? Z czym to się wiąże?
Temat lekcji: Alkeny. Otrzymywanie, właściwości chemiczne i zastosowanie alkenów.
Cele i zadania lekcji:
- rozważyć specyficzne właściwości chemiczne etylenu i ogólne właściwości alkenów;
- pogłębiać i skonkretyzować pojęcia ?-wiązań, mechanizmy reakcji chemicznych;
- podać wstępne pomysły na temat reakcji polimeryzacji i struktury polimerów;
- analizować laboratoryjne i ogólnoprzemysłowe metody otrzymywania alkenów;
- nadal rozwijać umiejętność pracy z podręcznikiem.
Ekwipunek: urządzenie do otrzymywania gazów, roztwór KMnO 4, alkohol etylowy, stężony kwas siarkowy, zapałki, lampa spirytusowa, piasek, tablice „Budowa cząsteczki etylenu”, „Podstawowe właściwości chemiczne alkenów”, próbki demonstracyjne „Polimery”.
PODCZAS ZAJĘĆ
I. Moment organizacyjny
Kontynuujemy badanie serii homologicznych alkenów. Dziś musimy zastanowić się nad metodami otrzymywania, właściwościami chemicznymi i zastosowaniami alkenów. Musimy scharakteryzować właściwości chemiczne wynikające z wiązania podwójnego, uzyskać wstępne zrozumienie reakcji polimeryzacji, rozważyć laboratoryjne i przemysłowe metody otrzymywania alkenów.
II. Aktywacja wiedzy uczniów
- Jakie węglowodory nazywamy alkenami?
- Jakie są cechy ich struktury?
- W jakim stanie hybrydowym znajdują się atomy węgla, które tworzą podwójne wiązanie w cząsteczce alkenu?
Podsumowując: alkeny różnią się od alkanów obecnością jednego wiązania podwójnego w cząsteczkach, które determinuje cechy właściwości chemicznych alkenów, metody ich wytwarzania i zastosowania.
III. Nauka nowego materiału
1. Metody otrzymywania alkenów
Ułóż równania reakcji potwierdzające metody otrzymywania alkenów
– pękanie alkanów C 8 H 18 ––> C 4 h 8 + C4H10; (pękanie termiczne w temperaturze 400-700 o C)
oktan buten butan
– odwodornienie alkanów C 4 H 10 ––> C 4 H 8 + H 2; (t, Ni)
butan buten wodór
– dehydrohalogenacja haloalkanów C 4 H 9 Cl + KOH ––> C 4 H 8 + KCl + H 2 O;
chlorobutan wodorotlenek chlorek butenu woda
potas potasowy
– dehydrohalogenacja dihaloalkanów 
- odwodnienie alkoholi C 2 H 5 OH --> C 2 H 4 + H 2 O (po podgrzaniu w obecności stężonego kwasu siarkowego)
Pamiętać!
W reakcjach dehydrogenacji, dehydratacji, dehydrohalogenacji i dehalogenacji należy pamiętać, że wodór jest głównie odłączany od mniej uwodornionych atomów węgla (reguła Zajcewa, 1875)
2. Właściwości chemiczne alkenów
Charakter wiązania węgiel – węgiel determinuje rodzaj reakcji chemicznych, w jakie wchodzą substancje organiczne. Obecność podwójnego wiązania węgiel-węgiel w cząsteczkach węglowodorów etylenowych determinuje następujące cechy tych związków:
- obecność wiązania podwójnego umożliwia klasyfikację alkenów jako związków nienasyconych. Ich przemiana w nasycone jest możliwa tylko w wyniku reakcji addycji, co jest główną cechą chemicznego zachowania olefin;
- wiązanie podwójne to znaczna koncentracja gęstości elektronowej, więc reakcje addycji mają charakter elektrofilowy;
- wiązanie podwójne składa się z jednego i jednego wiązania, które jest dość łatwo spolaryzowane.
Równania reakcji charakteryzujące właściwości chemiczne alkenów
a) Reakcje dodawania
Pamiętać! Reakcje podstawienia są charakterystyczne dla alkanów i wyższych cykloalkanów posiadających tylko wiązania pojedyncze, reakcje addycji są charakterystyczne dla alkenów, dienów i alkinów posiadających wiązania podwójne i potrójne.

Pamiętać! Możliwe są następujące mechanizmy break-link:
a) jeśli alkeny i odczynnik są związkami niepolarnymi, to wiązanie - zrywa się z utworzeniem wolnego rodnika:
H 2 C \u003d CH 2 + H: H --> + +
b) jeśli alken i odczynnik są związkami polarnymi, to zerwanie wiązania prowadzi do powstania jonów:
c) przy łączeniu w miejscu rozerwania odczynników zawierających atomy wodoru w cząsteczce wodór zawsze przyłącza się do bardziej uwodornionego atomu węgla (reguła Morkovnikova, 1869).
- reakcja polimeryzacji nCH 2 = CH 2 ––> n – CH 2 – CH 2 ––> (– CH 2 – CH 2 –) n
polietylen etylenowy
b) reakcja utleniania
Doświadczenie laboratoryjne. Uzyskaj etylen i zbadaj jego właściwości (instrukcje na ławkach studenckich)
Instrukcje otrzymywania etylenu i eksperymenty z nim
1. W probówce umieścić 2 ml stężonego kwasu siarkowego, 1 ml alkoholu i niewielką ilość piasku.
2. Zamknąć probówkę korkiem z rurką wylotową gazu i podgrzać w płomieniu lampki alkoholowej.
3. Przepuścić ulatniający się gaz przez roztwór nadmanganianu potasu. Zwróć uwagę na zmianę koloru roztworu.
4. Zapal gaz na końcu rury gazowej. Zwróć uwagę na kolor płomienia.
- Alkeny palą się świetlistym płomieniem. (Czemu?)
C 2 H 4 + 3O 2 --> 2CO 2 + 2H 2 O (przy całkowitym utlenieniu produktami reakcji są dwutlenek węgla i woda)
Reakcja jakościowa: „łagodne utlenianie (w roztworze wodnym)”
- alkeny odbarwiają roztwór nadmanganianu potasu (reakcja Wagnera)
W cięższych warunkach w środowisku kwaśnym produktami reakcji mogą być np. kwasy karboksylowe (w obecności kwasów):
CH 3 - CH \u003d CH 2 + 4 [O] --> CH 3 COOH + HCOOH
– katalityczne utlenianie
Zapamiętaj najważniejsze!
1. Węglowodory nienasycone aktywnie wchodzą w reakcje addycji.
2. Reaktywność alkenów wynika z faktu, że - wiązanie łatwo pęka pod wpływem odczynników.
3. W wyniku addycji następuje przejście atomów węgla ze stanu hybrydowego sp 2 - do sp 3 -. Produkt reakcji ma charakter ograniczający.
4. Gdy etylen, propylen i inne alkeny są ogrzewane pod ciśnieniem lub w obecności katalizatora, ich poszczególne cząsteczki łączą się w długie łańcuchy - polimery. Polimery (polietylen, polipropylen) mają duże znaczenie praktyczne.
3. Stosowanie alkenów(wiadomość studenta według poniższego planu).
1 - uzyskanie paliwa o wysokiej liczbie oktanowej;
2 - tworzywa sztuczne;
3 - materiały wybuchowe;
4 - środek przeciw zamarzaniu;
5 - rozpuszczalniki;
6 - przyspieszyć dojrzewanie owoców;
7 - otrzymywanie aldehydu octowego;
8 - kauczuk syntetyczny.
III. Konsolidacja badanego materiału

Praca domowa:§§ 15, 16, przykł. 1, 2, 3 s. 90, przykł. 4, 5 s. 95.
W chemii organicznej można znaleźć substancje węglowodorowe z różną ilością węgla w łańcuchu i wiązaniem C=C. Są homologami i nazywane są alkenami. Ze względu na swoją strukturę są bardziej reaktywne chemicznie niż alkany. Ale jakie dokładnie są ich reakcje? Rozważ ich rozmieszczenie w przyrodzie, różne metody pozyskiwania i aplikacji.
Czym oni są?
Alkeny, zwane również olefinami (olejami), swoją nazwę zawdzięczają chlorkowi etenu, pochodnej pierwszego przedstawiciela tej grupy. Wszystkie alkeny mają co najmniej jedno wiązanie podwójne C=C. C n H 2n to wzór wszystkich olefin, a nazwa powstaje od alkanu o tej samej liczbie atomów węgla w cząsteczce, tylko przyrostek -an zmienia się na -ene. Cyfra arabska na końcu nazwy przez myślnik wskazuje liczbę atomów węgla, od której zaczyna się wiązanie podwójne. Rozważ główne alkeny, tabela pomoże ci je zapamiętać:
Jeśli cząsteczki mają prostą nierozgałęzioną strukturę, dodaje się przyrostek -ylen, co również znajduje odzwierciedlenie w tabeli.
Gdzie można je znaleźć?
Ponieważ reaktywność alkenów jest bardzo wysoka, ich przedstawiciele w przyrodzie są niezwykle rzadcy. Zasada życia cząsteczki olefiny brzmi „bądźmy przyjaciółmi”. Wokół nie ma innych substancji – to nie ma znaczenia, zaprzyjaźnimy się, tworząc polimery.
Ale one istnieją, a niewielka liczba przedstawicieli jest zawarta w towarzyszącym gazie ropopochodnym, a wyższa w ropie naftowej wydobywanej w Kanadzie.
Pierwszy przedstawiciel alkenów, eten, jest hormonem stymulującym dojrzewanie owoców, dlatego przedstawiciele flory syntetyzują go w niewielkich ilościach. Istnieje alken cis-9-trikosen, który u samic much pełni funkcję atraktanta seksualnego. Nazywany jest również Muscalur. (Atraktant - substancja pochodzenia naturalnego lub syntetycznego, która powoduje przyciąganie do źródła zapachu w innym organizmie). Z punktu widzenia chemii ten alken wygląda tak:
Ponieważ wszystkie alkeny są bardzo cennymi surowcami, metody ich sztucznego pozyskiwania są bardzo zróżnicowane. Rozważmy najczęstsze.
A jeśli potrzebujesz dużo?
W przemyśle klasę alkenów uzyskuje się głównie przez kraking, tj. rozszczepienie cząsteczki pod wpływem wysokich temperatur, wyższych alkanów. Reakcja wymaga ogrzewania w zakresie od 400 do 700°C. Alkan rozszczepia się, jak chce, tworząc alkeny, metody otrzymywania, które rozważamy, z dużą liczbą wariantów budowy cząsteczek:
C 7 H 16 -> CH 3-CH \u003d CH 2 + C 4 H 10.
Inna popularna metoda nazywana jest odwodornieniem, w której cząsteczka wodoru jest oddzielana od przedstawiciela szeregu alkanów w obecności katalizatora.
W warunkach laboratoryjnych alkeny i metody otrzymywania są różne, opierają się na reakcjach eliminacji (eliminacji grupy atomów bez ich zastępowania). Najczęściej atomy wody są eliminowane z alkoholi, halogenów, wodoru lub halogenowodoru. Najczęstszym sposobem otrzymywania alkenów jest alkohol w obecności kwasu jako katalizatora. Istnieje możliwość zastosowania innych katalizatorów
Wszystkie reakcje eliminacyjne podlegają regule Zajcewa, która mówi:
Atom wodoru jest oddzielony od węgla sąsiadującego z węglem niosącym grupę -OH, która ma mniej wodorów.

Stosując regułę odpowiedz, który produkt reakcji będzie dominował? Później dowiesz się, czy odpowiedziałeś poprawnie.
Właściwości chemiczne
Alkeny aktywnie reagują z substancjami, zrywając ich wiązanie pi (inna nazwa wiązania C=C). W końcu nie jest tak mocny jak pojedynczy (bonus sigma). Węglowodór nienasycony zamienia się w nasycony bez tworzenia innych substancji po reakcji (dodawanie).
- dodanie wodoru (uwodornienie). Do jego przejścia potrzebna jest obecność katalizatora i ogrzewanie;
- dodanie cząsteczek halogenu (halogenacja). Jest to jedna z jakościowych reakcji na wiązanie pi. W końcu, gdy alkeny reagują z wodą bromową, stają się one przezroczyste z brązu;
- reakcja z halogenowodorami (hydrohalogenowanie);
- dodatek wody (nawodnienie). Warunki reakcji to ogrzewanie i obecność katalizatora (kwasu);
Reakcje niesymetrycznych olefin z halogenowodorami i wodą przebiegają zgodnie z regułą Markownikowa. Oznacza to, że wodór połączy się z węglem z podwójnego wiązania węgiel-węgiel, które ma już więcej atomów wodoru.

- spalanie;
- katalizator częściowego utleniania. Produkt to cykliczne tlenki;
- Reakcja Wagnera (utlenianie nadmanganianem w środowisku obojętnym). Ta reakcja alkenowa jest kolejnym wysokiej jakości wiązaniem C=C. Podczas przepływu różowy roztwór nadmanganianu potasu odbarwia się. Jeśli ta sama reakcja zostanie przeprowadzona w połączonym środowisku kwaśnym, produkty będą różne (kwasy karboksylowe, ketony, dwutlenek węgla);
- izomeryzacja. Charakterystyczne są wszystkie typy: cis- i trans-, ruch wiązań podwójnych, cyklizacja, izomeryzacja szkieletowa;
- polimeryzacja jest główną właściwością olefin dla przemysłu.
Zastosowanie w medycynie
Produkty reakcji alkenów mają duże znaczenie praktyczne. Wiele z nich znajduje zastosowanie w medycynie. Gliceryna jest pozyskiwana z propenu. Ten alkohol wielowodorotlenowy jest doskonałym rozpuszczalnikiem, a jeśli zostanie użyty zamiast wody, roztwory będą bardziej stężone. Do celów medycznych rozpuszcza się w nim alkaloidy, tymol, jod, brom itp. Glicerynę stosuje się również do przygotowania maści, past i kremów. Zapobiega ich wysychaniu. Sama gliceryna jest środkiem antyseptycznym.
W reakcji z chlorowodorem otrzymuje się pochodne, które stosuje się jako znieczulenie miejscowe po nałożeniu na skórę, a także do krótkotrwałego znieczulenia z niewielkimi interwencjami chirurgicznymi przy użyciu inhalacji.

Alkadieny to alkeny z dwoma podwójnymi wiązaniami w jednej cząsteczce. Ich głównym zastosowaniem jest produkcja kauczuku syntetycznego, z którego następnie wykonuje się różnego rodzaju poduszki grzewcze i strzykawki, sondy i cewniki, rękawiczki, smoczki i wiele innych, które są wręcz niezbędne w opiece nad chorymi.
Zastosowanie w przemyśle
| Rodzaj przemysłu | Co jest używane | Jak mogą używać |
| Rolnictwo | eten | przyspiesza dojrzewanie owoców i warzyw, defoliację roślin, folie do szklarni |
| Lako-kolorowe | eten, buten, propen itp. | do otrzymywania rozpuszczalników, eterów, rozpuszczalników |
| Inżynieria mechaniczna | 2-metylopropen, eten | produkcja kauczuku syntetycznego, oleje smarowe, płyny przeciw zamarzaniu |
| przemysł spożywczy | eten | produkcja teflonu, alkoholu etylowego, kwasu octowego |
| Przemysł chemiczny | eten, polipropylen, | uzyskać alkohole, polimery (polichlorek winylu, polietylen, polioctan winylu, poliizobtylen, aldehyd octowy |
| Górnictwo | eten itp. | materiały wybuchowe |
Alkeny i ich pochodne znalazły szersze zastosowanie w przemyśle. (Gdzie i jak używa się alkenów, tabela powyżej).

To tylko niewielka część zastosowania alkenów i ich pochodnych. Z roku na rok wzrasta zapotrzebowanie na olefiny, co oznacza, że rośnie również zapotrzebowanie na ich produkcję.
- Wyrażenia irracjonalne (wyrażenia z pierwiastkami) i ich transformacja
- Opowiadanie pracy „Opowieść o tym, jak jeden człowiek nakarmił dwóch generałów” Saltykowa-Szczedrina M.
- Wasilij Ermolaevich Bugor był nawigatorem arktycznym i jednym z pionierów Syberii
- Izomery areny. Budowa cząsteczek arenowych. Stabilizacja kompleksu σ. Odbywa się to przez oddzielenie protonu od kompleksu σ za pomocą zasady. W tym przypadku, dzięki dwóm elektronom zerwania wiązania kowalencyjnego C - H, przywracany jest zamknięty układ π
- Jaki sprzęt postawić na barszcz poziom 8
- M56 Scorpion — amerykański niszczyciel czołgów VII poziomu
- Właściwości chemiczne cynku i jego związków
- Poziomy organizacji życia systemów żywych
- Jak ugotować forszmak ze śledzia w Odessie po żydowsku i w nowy sposób Forszmak ze śledzia klasyczna żydowska receptura
- Amerykańskie ciasto z dyni
- Ciasto twarogowe bez pieczenia z truskawkami
- Sałatka „Grzyby pod śniegiem” Sałatka „Grzyby pod śniegiem” - przepis krok po kroku ze zdjęciem
- Ciasteczka kruche czekoladowe ze smalcem
- Domowy kawior z cukinii w powolnej kuchence na zimę: prosty i bardzo smaczny kawior z cukinii szybki przepis w powolnej kuchence
- Pasztety mięsne z ciasta drożdżowego Nadzienie mięsne do pasztetów jak gotować
- Naleśniki z cukinii Jak zrobić naleśniki z cukinii
- Sucharki w piekarniku, temperatura
- Przepisy na pierniki dla doskonałych przepisów na pierniki z lekkim lukrem
- Jak ugotować kawior z cukinii w tradycyjny sposób iw powolnej kuchence?
- Zaklęcia, aby zadzwonić na randkę Zaklęcia, aby zadzwonić na randkę